近日,国家药监局药品审评中心发布通知《自体CAR-T细胞治疗产品药学变更研究问题与解答(征求意见稿)》。细胞与基因治疗(CGT)主要开发方向主要集中在基因疗法、免疫细胞疗法与干细胞疗法三大类,其中免疫细胞疗法(CAR-T)目前是研究与临床应用的热点领域。全球共有8款CAR-T产品获批上市,国内有两款CAR-T产品获批上市,有百余个产品在临床试验阶段。

CAR-T技术的快速迭代使得我们对产品工艺、安全性与疗效的理解仍在不断深化,而产品中的可提取物与渗出物可能影响细胞活力、细胞操作与最终产品,这需要开展专门研究与建立相关标准来妥善控制风险。
目前,对CGT产品的提取物与渗出物研究与规范还无法完全满足其独特要求。CAR-T等免疫细胞疗法涉及对人体免疫细胞的体外操纵与扩增,其中使用的一次性设备与有限的细胞纯化工艺可能产生有害的细胞退变物与可溶性因子。若这些物质输注入患者体内,可能导致严重不良事件,甚至危及生命。因此,开展CGT产品中提取物与渗出物的研究对确保其安全性与质量至关重要。
生物工艺系统联盟(BPSA)于2020年发布技术指南《细胞和基因治疗药品开发中的可提取物/浸出物考虑因素》(Extractables/Leachables Considerations for Cell & Gene Therapy Drug Product Development)。该项目为期11个月,由BPSA成员公司Millipore Sigma、VR Analytical、Smithers MDT、Colder Product Company(CPC)、Solvay、Entegris、Gemini Bio、American Renolit和Chemic的专家委员会指导和执行。

图1 技术指南目录
该指南反映了行业为提高基于聚合物的一次性使用生物工艺系统在洁净度、安全性和性能方面取得的进展。该指南被称为“BPSA 2020 CGT提取物指南”,包含17页/9个部分的内容,根据一次性使用技术(SUT)行业中普遍问题,提出CGT提取物的解决方案。
指南中第7部分是术语,第8部分是附加信息,第9部分是参考资料。
现就第1部分至第6部分内容介绍如下:
第1部分 介绍
细胞与基因治疗CGT生产过程中的浸出物来源于一次性使用系统,可能对CGT产品的质量、安全性和制造过程产生不利影响。某些浸出物直接接触患者可能产生安全问题,特别是免疫功能低下的患者,其引入的安全风险不可忽视。
浸出物也可能与CGT产品存在化学反应性或细胞毒性方面的相容性问题,并可能通过遗传毒性效应引起癌变。因此,必须评估和控制CGT产品中的浸出物,包括潜在浸出物和实际产品中浸出物。
FDA和其他组织如PQRI已发布多份指南,讨论药品包装、一次性生产系统相关的浸出物问题,可用于评估和控制CGT浸出物的参考。
第2部分 与传统的E&L相比,CGT的特殊要求
与传统生物制药相比,CGT生产过程存在以下显著特点:
- 在传统生物制药中,细胞用于生产原液(DS),而在CGT中,细胞本身就是产品。
- 传统生物制药过程中相关杂质(PERLs)可通过下游纯化过程从DS中分离和除去,CGT除了几个洗涤步骤之外,没有机会将杂质从产品中分离出来。
- CGT可以认为是一种小规模生产过程,涉及细胞采样、操作和培养,生产高度依赖一次性使用技术(SUT)。
- CGT的工艺流程的条件倾向于接近生理条件,不使用极端pH和/或有机溶剂。
- 最终CGT产品通常包含二甲亚砜(DMSO)以冻助细胞,支撑低温运输到使用点。
需要对CGT制造过程中使用的每个组件接触材料进行风险分析,需要考虑的变量包括:
- 与最终产品的距离
- 溶液的提取能力
- 接触时间
- 接触温度
- 接触表面积
- 材料预处理材料兼容性以及供应商提供的支持等
许多常规的提取研究不支持CGT特有的工艺步骤,需要考虑CGT生产过程使用的溶剂、温度与时间等条件。例如,应考虑将二甲亚砜作为溶剂,并评估塑料件暴露于二甲亚砜的总时间。
第3部分 风险评估
在CGT应用的风险评估中需要考虑3个主要方面:
- 浸出物对细胞活力的影响以及不良刺激效应
- 有限的细胞纯化步骤,过程相关的杂质可能会保留在产品中
- 在干细胞疗法中,操作可能导致的细胞退行性改变(degenerative cells)
来自一次性用技术的大多数浸出物对典型宿主细胞无显著影响,但根据报道某些浸出物的确存在风险。
常见的PERLs(工艺相关的浸出物)提取方案和分析技术应用到CGT时应考虑:
- 常见可提出物方案要求使用的提取条件也满足CGT应用的“最坏情况”。
- 对于CGT是否需要有额外的考虑因素。
- 提取样品需要进行全面分析评估(GC/MS,UPLC/MS,顶空GC/MS,ICP-MS,IC等)。
- 是否存在吸附在细胞上或被细胞吸收的浸出物。
- 离体细胞对浸出物的敏感性是否高于整体有机体。
致癌性、诱变性或遗传毒性化合物(CMR)的影响:由于对CMR的了解基于系统性影响的数据(即整个有机体的反应)。因此,不能排除在CGT应用中操作的离体细胞对CMR更敏感的可能性。
评估浸出物风险需要考虑多种因素,如材料属性、工艺条件、接触工艺流的化学性质等。可参考USP<1665>的风险矩阵。
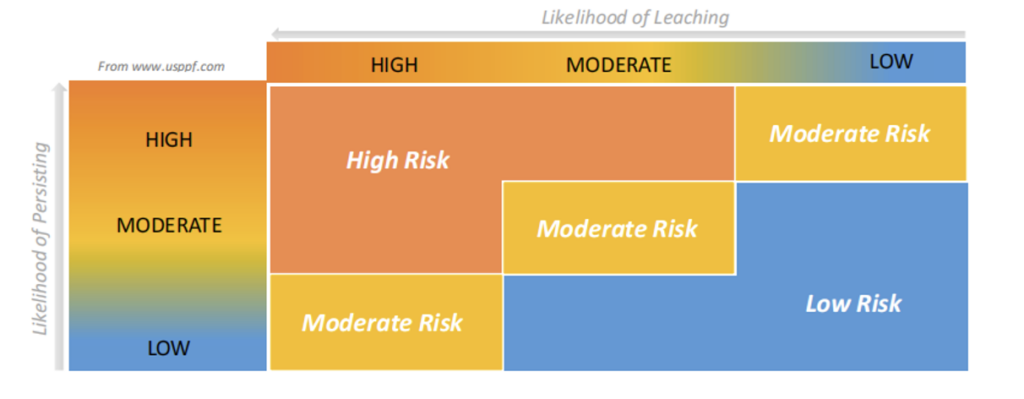
图2 USP<1665>风险评估矩阵
CGT应用中,浸出物不仅能溶解到产品中,也可能被细胞吸附或吸收。这需要开发能检测CGT中细胞内外浸出物的方法,最大限度减少安全风险。
第4部分 监管考量
目前没有监管指南专门支持和管理使用一次性和多次性系统的CGT生产。但鉴于聚合物与弹性体材料都可能产生浸出物,监管要求控制和减少工艺过程材料对产品质量和安全性的影响。
行业及监管机构均达成一致,需要系统评估一次性用技术的潜在浸出物,以评估CGT应用的风险。
目前仍无最终的法规或指南适用于CGT产品的浸出物限值。但USP、ICH等组织正在努力达成这一目标。
第5部分 CGT的独特挑战
与传统生物制药相比,评估CGT产品中的可提取物与浸出物面临独特的挑战:
CGT产品中浸出物不仅溶解在溶液中,也可能吸附于细胞表面或被细胞吸收,这需要开发新的评估方法。
目前的研究可提供浸出物累积水平的信息,但可能无法直接评估其对细胞活力的影响,这需要进一步研究。
CGT治疗涉及细胞操作,这可能增加浸出物与细胞相互作用的复杂性,现有标准可能不足以全面评估安全风险。
第6部分 CGT传递系统E&L测试的责任
- 完成全面的E&L研究是CGT产品申报者的责任。
- 随着一次性用技术的广泛使用,监管要求也在增加,申报者需证明研究设计满足要求。
- 申报者可选择内部或外部实验室合作进行E&L测试,各有优势。
- 可应用一次性使用技术供应商提供可提取物数据,但最终责任仍属于申报者。
小结
细胞疗法作为一种新兴治疗手段,有望治疗多种疾病,包括癌症、肝病和原发性免疫缺陷症,其研究结果关系到患者的治疗结果与预后。细胞与基因治疗(CGT)产品中的渗出物来源于体外细胞扩增和操作过程中使用的一次性系统,其中的化合物可能对细胞具有影响,必须进行严密监测与控制。
指南最后强调,随着监管标准的日益严格,申办者对研究结果负最终责任。选择经广泛评价的安全材料,深入理解CGT工艺流程,是开发与实施高质量提取物与渗出物研究方案的保证。同时,期待相关方持续努力,推动CGT产业加速健康发展与规范推进。
伯朗氏实验室在E&L研究领域积累了丰富经验。我们很乐意与您分享研究心得。欢迎随时联系我们的客户服务团队获取更多信息与案例分析,让我们启动一场富有成效的交流与合作。
感谢阅读🙏,求关注公众号🤭,网址和联系方式见下,随时恭候🌹

伯朗氏实验室: https://www.brunslab.com
联系电话:18816792607






