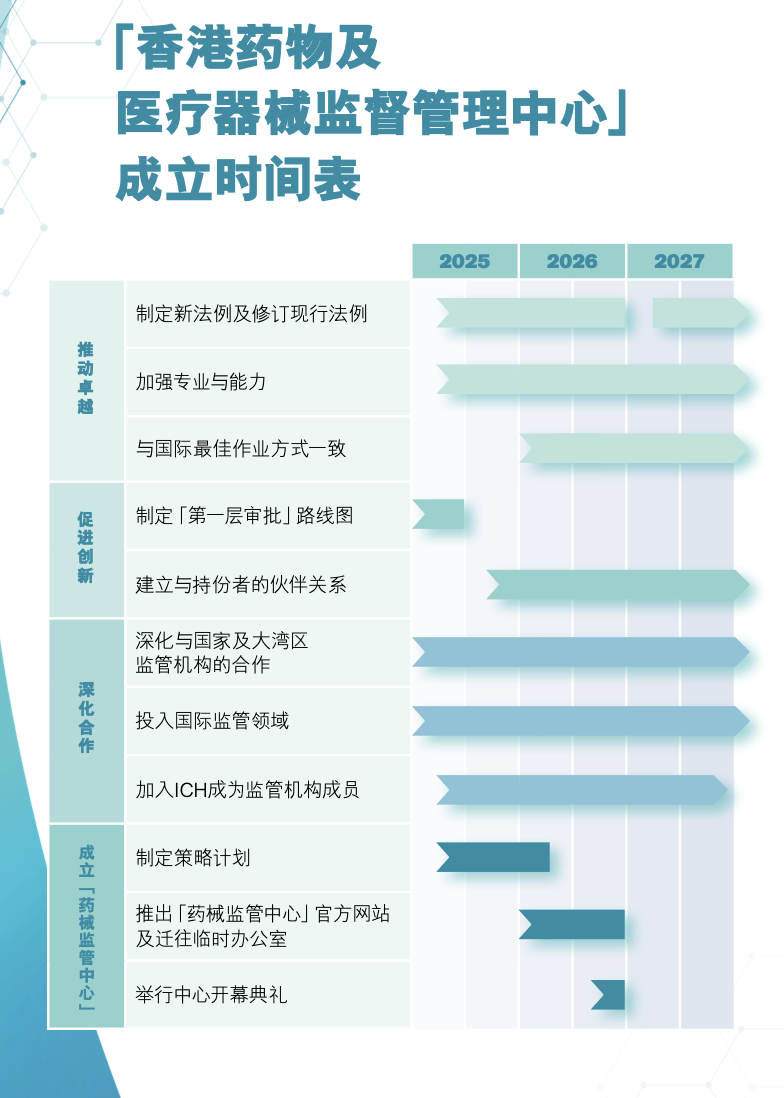
2025年6月26日,香港卫生署正式公布“香港药物及医疗器械监督管理中心”(以下简称香港药械监管中心,CMPR)成立时间表及新药“第一层审批”路线图,这一举措预示着香港在药械监管领域即将迎来深刻变革。
CMPR 的成立,不仅是香港打造国际医疗创新枢纽的关键一步,也将对国内药械行业产生深远而积极的影响。
CMPR:精心构筑香港药械监管新蓝图
CMPR 的成立并非朝夕之功,而是经过了精心筹备与周密规划。以下是 CMPR 组建历程中的关键时间节点:
- 2023年 11 月: 香港推出“1+”机制,为 CMPR 未来实施“第一层审批”奠定坚实基础。
- 2024年 6 月5日: 卫生署成立 CMPR 筹备办公室,标志着 CMPR 的筹备工作正式拉开帷幕。
- 2024 年 11 月1日起:“1+”审批机制扩展至所有新药,包括疫苗及先进疗法制品,充分体现“好药港用”的理念。
- 2026 年起: 卫生署将分阶段稳步推行新药“第一层审批”注册机制。
- 2026 年底: CMPR 预计正式挂牌成立,全面整合西药、中药及医疗器械的监管职能。
- 2030 年: 香港特区政府力争全面实现新药械的自行审批。
CMPR 的功能与职责
CMPR 绝非简单的机构更名,而是肩负着提升香港药械监管水平、促进产业创新发展的重任。其主要功能与职责涵盖以下方面:
- 整合监管职能: 全面整合香港现行的西药、中药和医疗器械监管职能,实现统一高效管理,提升监管效能。
- 制定法规标准: 负责制定和完善香港药械相关的法律法规与技术标准,积极与国际标准对接,确保监管的科学性和规范性。
- 开展注册审批: 负责药械产品的注册审批工作,大力推行“第一层审批”机制,加速创新药械在香港市场的上市进程。
- 实施上市后监管: 进一步加强对上市药械产品的质量监管,切实保障公众用药安全。
- 促进产业发展: 通过优化监管环境、积极吸引投资和人才等多种方式,全力推动香港医疗及生物科技产业的蓬勃发展。
- 加强国际合作: 积极加强与国际药械监管机构的交流与合作,显著提升香港在国际药械监管领域的影响力与话语权。
香港“1+”审批机制详解
该机制旨在简化新药注册流程,显著缩短审批时间,使患者能够更快地获得前沿创新药物的治疗。
“1+”机制的核心内容
“1+”机制的核心在于,新药注册申请人只需提交一份(而非原先的两份)来自参考国家或地区药物监管机构的许可证明,即可申请注册。但前提是,必须提供符合香港要求的本地临床数据,并获得香港本地专家的充分认可。
具体解读:
“1”代表一份参考国家或地区监管机构的许可:申请人可选择提供来自一个获得香港卫生署认可的监管机构(如美国 FDA、欧盟 EMA、日本 PMDA 等)出具的批准文件。
“+”代表本地临床数据与专家认可:申请人需要提供在香港本地开展的临床试验数据,充分证明相关药物在香港人群中的安全性和有效性,并获得香港本地专家的权威认可。
CMPR 对国内药械行业的影响与意义
- 加速国内创新药械“走出去”: CMPR 实施的“第一层审批”机制将为国内创新药械开辟更为便捷的注册通道,加速其成功进入香港市场。凭借香港作为高度国际化市场的优势,其认可将有力助推国内药械产品走向更广阔的国际舞台。
- 提升国内药械质量标准: 为全面满足 CMPR 的注册要求,国内药械企业势必需要持续提高产品质量和研发水平,这将在客观上推动国内药械行业的整体质量升级。
- 推动中医药国际化: CMPR 将不断完善中药监管制度,充分发挥香港作为中医药国际化桥头堡的重要作用,为国内中药企业拓展海外市场提供更多宝贵机遇。
- 吸引国际投资和人才: CMPR 的成立将显著提升香港作为国际医疗创新枢纽的吸引力,吸引更多国际资本与高端人才汇聚,为国内药械企业创造更多合作共赢的机会。
图片来源于“香港药物及医疗器械监督管理中心—迈向第一层审批”