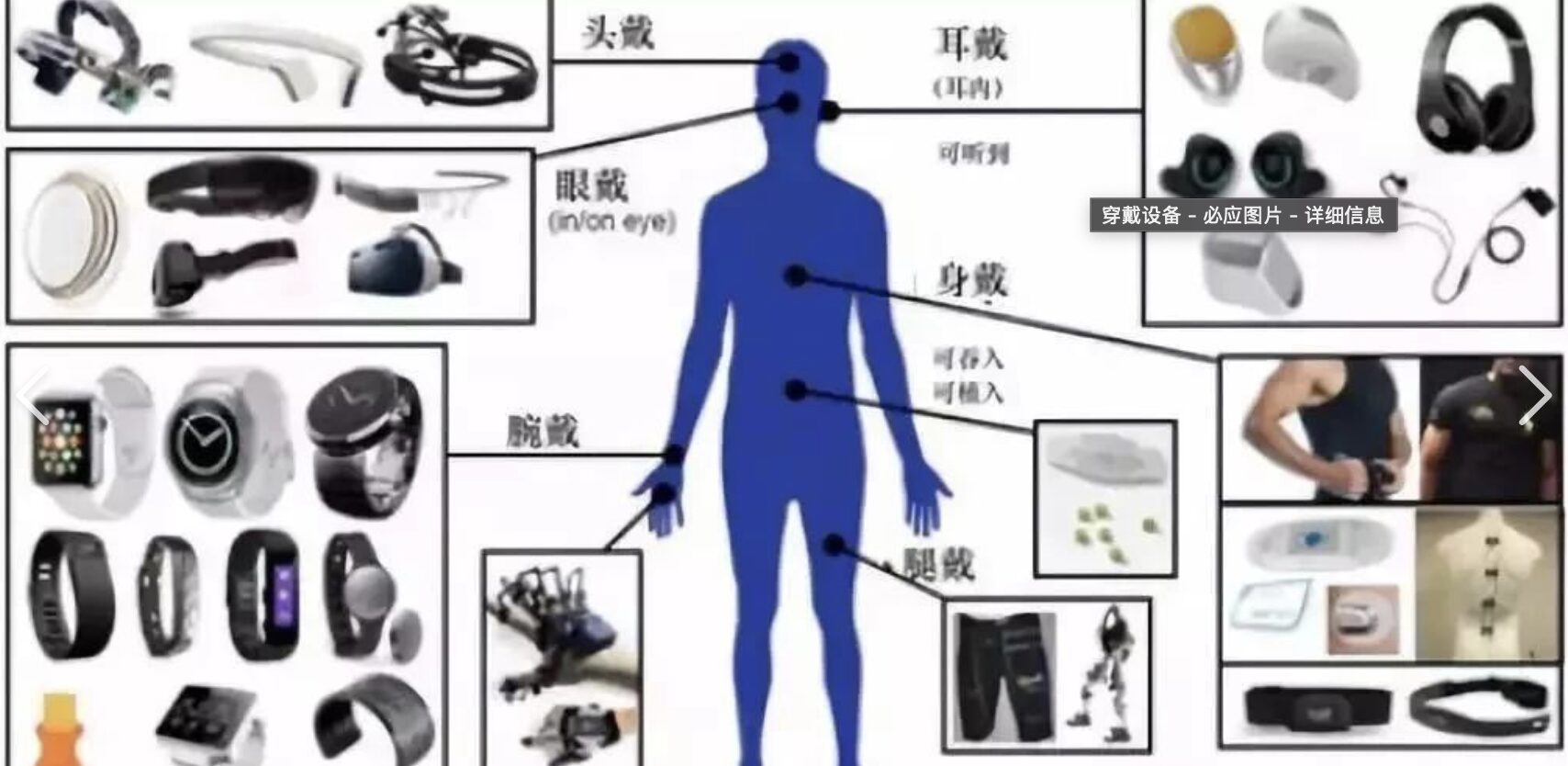
引言:从“电子配饰”到“健康中枢”的跨越
站在2026年的起点,可穿戴健康设备已不再仅仅是手腕上的时尚点缀。根据最新统计,近50%的美国人已经习惯于佩戴健身追踪设备,而在Gen Z(Z世代)群体中,这一比例更是高达惊人的70%。可穿戴设备正迅速进化为人体的数据化“哨兵”。
2026年1月6日,美国食品药品监督管理局(FDA)发布的一则通告,标志着数字健康监管逻辑的根本性转向。
FDA宣布将限制对可穿戴医疗设备的监管范围,转而采取一种更加灵活、鼓励创新的“有限监管”模式。这一政策不仅推动了苹果(Apple)、Fitbit、Garmin以及Oura等巨头股价的应声上涨,更在全行业内引发了关于“技术边界、企业责任与创新自由”的深度讨论。
与此同时,作为全球最大的可穿戴设备市场之一,中国在这一领域的监管路径也呈现出既与国际接轨又具本土特色的演进态势。
第一部分:FDA的战略转向
长期以来,FDA对医疗器械的界定始终是行业头顶的“达摩克利斯之剑”。但在2026年初的新规中,监管机构展现出了前所未有的开放态度。
1.1 “信息提供”与“医学诊断”的明确分野
FDA专员马蒂·马克里(Marty Makary)在接受福克斯商业频道(Fox Business)采访时,清晰地划定了监管红线:“我们希望通过非常明确的指南让公司知道,如果他们的设备或软件只是简单地提供信息,他们就可以在不受FDA监管的情况下进行研发与销售。”
这一表态的核心逻辑在于:
- 非医疗设备豁免: 绝大多数追踪睡眠、卡路里消耗、步数及日常压力的追踪器,由于其不涉及疾病的直接诊断或治疗,将被归类为非医疗设备,从而豁免于严格的临床前审批流程。
- 医疗级(Medical Grade)的门槛: 马克里明确强调,如果企业声称其设备能够监测血压、进行疾病诊断或处方级治疗建议,FDA仍将维持最严厉的监管审查。
1.2 监管哲学的重构:安全卫士还是创新推手?
马克里指出:“我们必须在推广这些产品的同时,防范重大安全隐患。”这种平衡术的背后,是FDA意识到数字技术迭代速度(以月计)与传统医疗审批周期(以年计)之间的天然矛盾。通过“松绑”非诊断类功能,FDA实际上将有限的行政资源集中到了高风险、高关键性的医疗决策设备上。
1.3 市场瞬时反应:资本的集体“狂欢”
新规发布后,市场迅速给出了正面反馈:
- 连续血糖监测(CGM)巨头雅培(Abbott)、美敦力(Medtronic)和德康(Dexcom)股价上涨1%至4%。
- 知名智能手表制造商佳明(Garmin)股价涨幅接近3%。
- 戒指类设备新锐Oura在2025年完成9亿美元融资后,估值已达11亿美元。
资本市场的热捧不仅是对苹果等现有巨头的利好,更是对初创企业“入场门槛降低”的乐观预判。
第二部分:营销话术下的监管博弈
在FDA新规下,一个极具争议的概念被推向台前——预期用途(Intended Use)。这决定了产品是作为“运动配件”还是“医疗器械”存在,而区分两者的往往不是硬件本身,而是营销词汇。
2.1 营销驱动监管
在新监管框架下,即便两台设备的传感器性能完全一致,如果A公司宣称其能“追踪健康趋势”,而B公司宣称其能“筛查高血压”,两者的命运将截然不同。
- A公司: 属于健康监测,无需FDA审查,可快速迭代。
- B公司: 属于医疗诊断,需进行数年的临床试验并获取FDA认证。
2.2 制造商权力的“背面”:临床验证与自律
FDA的权力收缩,实质上将责任转嫁给了企业。马蒂·马克里和多位数字健康领域CEO均指出,临床验证(Clinical Validation)、上市后监测和数据透明度将更多地落在制造商身上。
如果企业为了获取更高的溢价或市场份额,在营销文案中故意模糊“健康建议”与“医疗诊断”的边界,2026年的监管环境将变得极其敏锐。FDA虽然减少了前置审查,但强化了后置追责。
正如Oura首席执行官汤姆·黑尔(Tom Hale)所言:“现代监管承认早期意识与医疗诊断之间的差异至关重要。作为行业领导者,我们不能因此而过度兴奋,而应加强对自身技术的真实性把关。”
第三部分:全民可穿戴时代的“数据主权”
FDA此举并非孤立的行政决策,而是美国政府数字化健康战略的一环。
100%覆盖目标:全美健康档案
在2025年6月的一次听证会上,美国卫生与公众服务部(HHS)部长小罗伯特·F·肯尼迪(Robert F. Kennedy Jr.)提出了一个激进的目标:“在四年内让每个美国人都佩戴上可穿戴设备。”
这种官方背书释放了三个关键趋势:
- 个性化预防: 从“病后治疗”向“病前干预”转型,通过可穿戴设备捕捉用户数据,减少公共医疗支出。
- 数据掌控权: 可穿戴设备将健康数据的所有权交还给患者,使个人能够根据趋势(而不是单次体检报告)调整生活方式。
- 数字健康筛查器(Digital Health Screeners): Oura CEO汤姆·黑尔提出,应该建立一种新的分类,即“数字健康筛查器”,通过展示长期趋势和范围变化,负责任地支持公众福祉,而无需取代临床诊断。
第四部分:中国市场的监管格局
在FDA走向“有限监管”的同时,中国作为全球最大的可穿戴设备制造与应用市场,也建立了一套独具特色的监管体系。
4.1 NMPA的分类监管逻辑
在中国,国家药品监督管理局(NMPA)对可穿戴设备的态度始终保持严谨。
- 医疗器械目录: 如果可穿戴设备具备心电图(ECG)、血氧饱和度监测(需用于诊断用途时)或无创血压监测功能,且宣称具有医疗诊断目的,则必须作为第二类医疗器械进行管理。
- 运动健康类产品: 仅具备计步、心率监测(运动参考)、睡眠分析等功能的设备,归类为普通消费电子产品,不受NMPA强制认证约束。
4.2 中美监管差异:从“先放后管”到“路径先行”
相比FDA在2026年展现出的“松绑”趋势,中国监管机构更倾向于通过明确的行业标准和指导原则来规范市场。
- 临床评价要求: 中国对于具备医疗功能的设备,要求提供详尽的临床评价资料或进行临床试验,审批过程相对规范且严格。
- 移动医疗应用(App)监管: 中国在2017年及随后多次发布移动医疗器械注册技术审查指导原则,明确了App作为医疗器械组成部分或独立软件的准入规则。
4.3 中国厂商的崛起与监管适应
华为(Huawei)、小米(Xiaomi)等中国巨头在“出海”与“内销”中积累了双重经验。
- 华为路径: 华为Watch系列多款产品已获得NMPA二类医疗器械注册证(如心电分析、血压测量),这使其在与Apple Watch的竞争中,在“医疗权威性”维度占据了高地。
- 技术溢出: 中国厂商正在利用完善的供应链,尝试将更高级的传感器(如血糖趋势监测)嵌入设备,并积极与国内大型医院开展“医工结合”项目。
第五部分:2026未来展望——创新与合规的共生
FDA的新规是一场实验。它假设通过降低监管成本,可以激发更多类似Oura、Whoop这样的数字健康新锐。然而,这场实验的成败取决于技术本身。
5.1 产品定位优于技术参数
在未来12个月内,产品定位和语言选择将比硬件传感器本身更重要。 那些理解“从健康切入、逐步沉淀数据、谨慎跨越医疗红线”逻辑的公司,将成为最终的赢家。
5.2 全球监管趋同与个性化差异
尽管FDA在松绑,但全球范围内对数据隐私和算法透明度的要求却在同步提升。中国对医疗器械数据安全的规定(如数据境内存储)也为可穿戴设备设定了另一条隐形红线。
5.3 结论:数字健康不只是“wellness”
Virgobit首席执行官奥米德·阿巴斯(Omid Abbasi)总结道:“通往数字健康的道路通常始于‘健康(Wellness)’,而非‘医疗器械’。理解这一逻辑的人,可以跨越单纯的监管管理,开始利用监管差异进行战略布局。”
结语:
2026年FDA的监管新规不仅是一个行政指令,它是一份邀请函——邀请科技公司在更自由的环境下重塑医疗体系。但自由是有代价的:当监管机构退后一步时,企业必须向前迈出一步,以更高的临床验证标准和更诚实的营销准则,去赢得消费者的长期信任。