注射器是医疗领域最重要的工具之一,在过去几年,医学界对注射器的需求持续增加,从2013年至2020年间,注射器的全球销售额估计增加约300亿美元。尤其是自新冠病毒疫情以来,由于疫苗接种令皮下注射器的使用量急剧增加。
尽管市面上已设计了不同类型的注射器,但所有注射器在结构上基本相同,主要组成部分包括活塞、筒身、针头和护帽,如图1所示。
塑料注射器是按照III类管理的医疗器械,主要用于非肠道给药。注射器及其材料必须满足透明度、水蒸气渗透性、泄漏和细胞毒性等测试。此外,它们还需要符合机械、热力和电气性能、无菌性、耐化学性和可提取物/可浸出物等方面的要求。表1汇总了不同类型的注射器分类。
表1 注射器常见类型

所使用的注射器必须有效且质量良好,国际标准化组织(ISO)发布了注射器的测试程序和最低规范,以下列出部分注射器国际标准:
-
TS EN ISO 8537 Sterile single-use syringes,with or without needle,for insulin
-
TS EN ISO 21533/AC Dentistry – Reusable cartridge syringes intended for intraligamentary injections
-
TS EN ISO 7886-1 Syringes-Hypodermic-Single use,sterile Part1: Syringes-Manual
-
TS EN ISO 7886-2 Sterile hypodermic syringes for single use – Part 2: Syringes for use with power-driven syringe pump
-
TS EN ISO 7886-3 Sterile hypodermic syringes for single use – Part 3: Auto-disable syringes for fixed-dose immunization
-
TS EN ISO 7886-4 Sterile hypodermic syringes for single use – Part 4: Syringes with re-use prevention feature
-
TS ISO 11040-3 Prefilled syringes – Part 3: Seals for dental local anesthetic cartridges
-
TS EN ISO 9997 Dental Cartridge Syringes
根据ISO标准化组织的标准,泄漏是注射器性能的重要参数。注射器设计时应考虑避免任何漏液,这是保证其无菌效果的重要保证。
研究发现,除硅油外,注射器漏液率也与界面表面粗糙度、橡胶的粘弹性能以及聚四氟乙烯涂层的弹性能等因素相关。通过改变橡胶表面的形变态度可以降低漏液率。
3|异物/颗粒
注射器本身就是总颗粒负荷的来源之一。例如,可能来源于注射器本身、硅腈或其他润滑剂、橡胶或纤维素等组分脱落形成的内在或外在颗粒。
案例1:注射器璧上灰色颗粒
切开塑料注射器后用光学显微镜检查,观察注射器壁上的浅灰色颗粒。

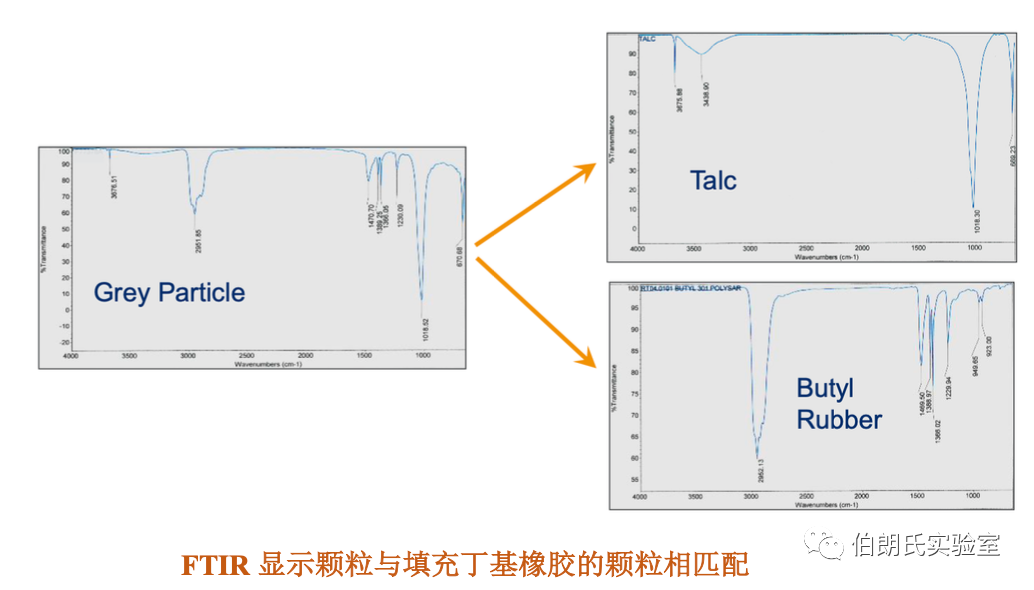
调查结论:浅灰色颗粒来源于注射器柱塞的丁基橡胶中填充剂滑石。
案例2:注射器内黑色异物
J Anaesthesiol Clin Pharmacol.报道过注射器的颗粒物污染《Particulate Contamination in Intravenous Drugs: Coring from Syringe Plunger 》,发现三个明显的黑色颗粒漂浮在注射器中,过滤后颗粒物似乎是黑色橡胶。进一步调查原因,可以观察到颗粒从注射器柱塞上脱落。
对于一个合格的注射器,这种问题不应该发生,为保证注射器的质量和患者安全,生产企业应加强生产过程管理,确保不产生这类问题。

| 总 结 |
只有通过不断完善质量体系和产品水平,加强监管,才能真正提升中国注射器行业的水平和信誉,为用户提供安全可靠的产品。
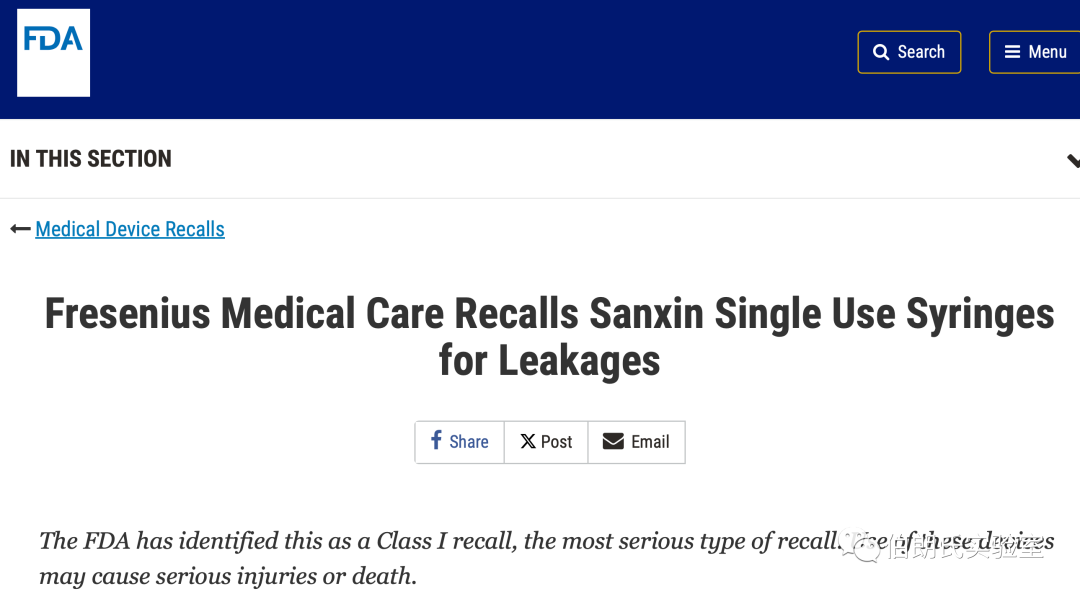
1. FDA Fresenius Medical Care Recalls Sanxin Single Use Syringes for Leakages.
https://www.fda.gov/medical-devices/medical-device-recalls/fresenius-medical-care-recalls-sanxin-single-use-syringes-leakages
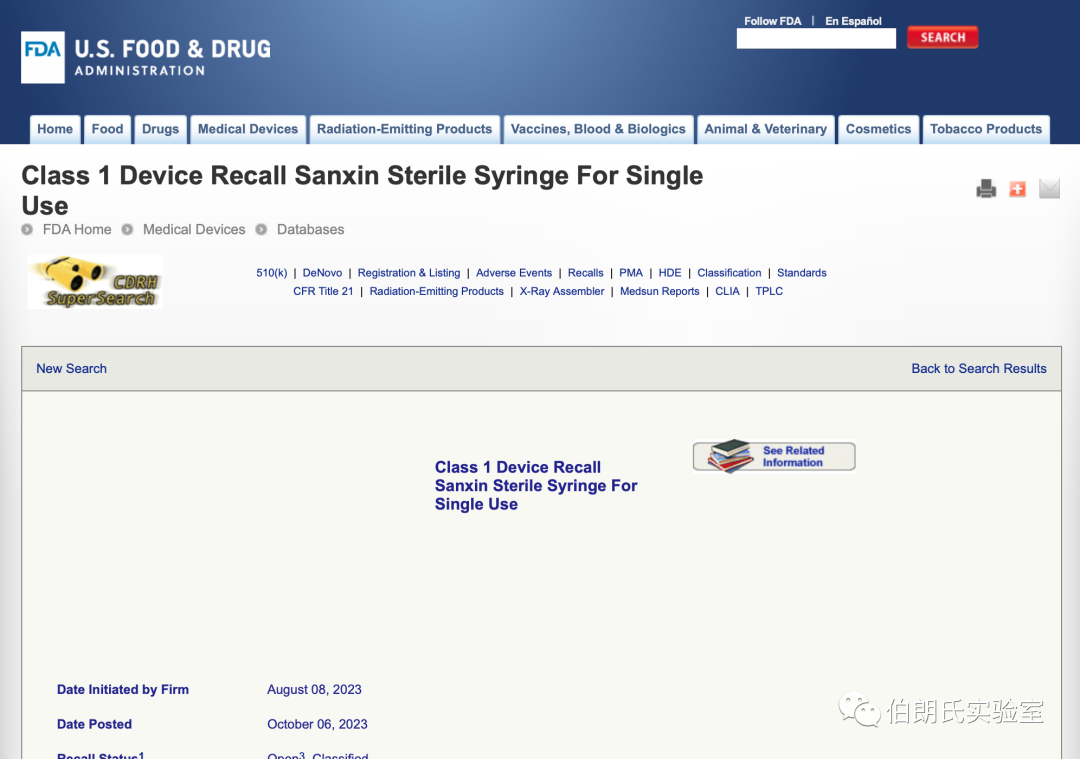
2. FDA : Class 1 Device Recall Sanxin Sterile Syringe For Single Use
4.Singhal S K, Particulate Contamination in Intravenous Drugs: Coring from Syringe Plunger. J Anaesth Clin Pharmacol 2010; 26(4): 563-572.


 。
。一波广告送上


 ~~~
~~~
伯朗氏实验室:
元素:采用ICP-MS进行痕量分析。可定量分析超65种元素










