近十年来,塑料被广泛应用于药品容器密封系统(CCS)以及生物制药加工的一次性(SUS)生产组件设备中。由于国内和国际的法规明确要求需要证明使用材料的安全性(1,2)。为此,无论生物制药还是化学注射剂都被要求对药品包材、容器和生产组件材料进行全面的可提取物和可浸出物(E&L)测试。
在进行药品包材、容器和生产组件的可提取物测试时,面临多种结构各异的化合物表征和定量的问题。
可提取物和可浸出物(E&L)研究时进行化合物筛选的常用的分析工具包括气相色谱-质谱(GC-MS)和液相色谱-质谱(LC-MS)。最理想的情况是,单次色谱进样分析可完成可提取物的筛选。
提取物筛选的一般流程
-
确定要分析的化合物系列,然后分别选择每个系列的代表性物质来验证。选择的化合物应涵盖典型的可提取物中每种化学类别的的代表和重要关键的可提取物(如存在毒理学问题或普遍存在的物质)。
-
确定相关的参数,包括单个化合物的线性、重复性、中间精密度、定量限(LoQ)和检测限(LoD)。
-
评估针对各可提取物化学类别的分析方法的适用性。例如,线性烷烃十二烷可作为烃类化学物质的代表,而辛酸可用于评估脂肪酸的方法性能。
为了获得可靠且准确的测量结果,通常使用认证的标准混合物质(CRM)。但由于目前尚未为塑料材料和塑料添加剂建立CRM,因此各实验室需要开发适用于GC-MS和LC-MS分析的CRM,以涵盖最常见和相关的提取物和浸出物(E&L)。伯朗氏实验室在过去十年中开发和建立了CRMs 涵盖最常见的药包材和生产组件可提取物和浸出物化合物库,保证了筛选时的高效率和准确度。
CRMs的开发、认证方法、方法验证和质量控制应用
由于液相色谱-高分辨率质谱(LC-HRMS)是药包材生产组件相容性研究E&L测试中最难应用的部分,我们将重点介绍LC-MS分析的仪器和方法设置的技术细节。
开发和认证
适用于E&L的CRMs混合物的选择
需要考虑符合大多数参与E&L测试的生产组件、药包材的组分,以及实验室的条件和需求。
E&L筛选标准中的化合物要能有代表性,涵盖多类聚合物、塑料添加剂和加工助剂。同时考虑这些入选的化合物至少可以用LC和GC技术中的一种常用检测器进行检测。
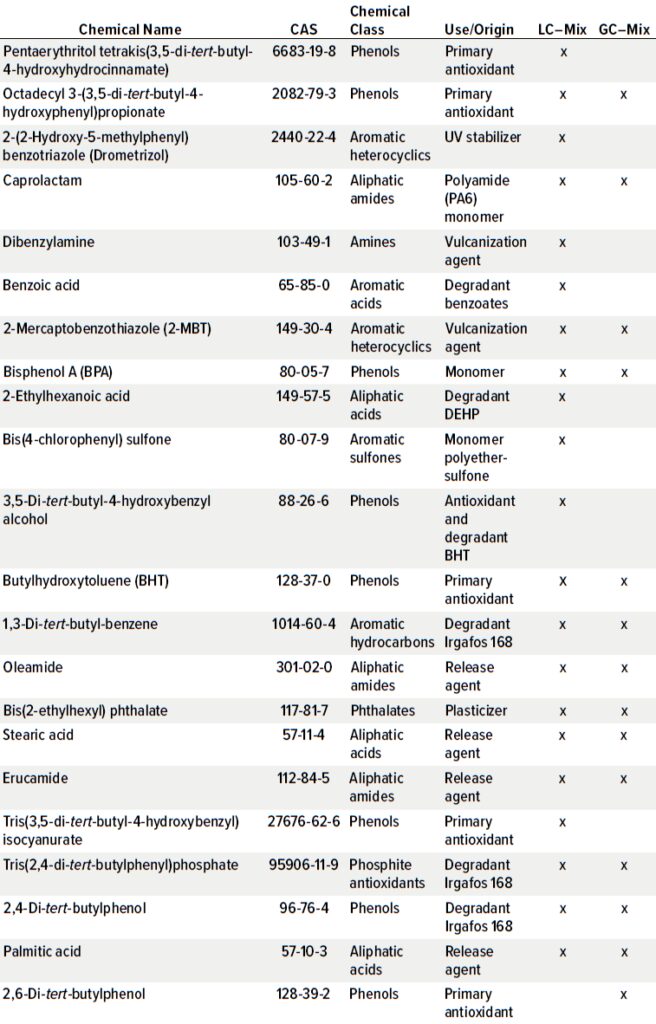
表1显示了用于LC和GC的E&L筛选标准的组成。包括化学类别的分类以及常见用途和来源,涵盖了典型的抗氧化剂和降解剂、加工助剂(如脱模剂、固化剂、增塑剂、紫外线吸收剂和聚合物单体),以及E&L研究中可能遇到的大多数化学类别。
E&L(可提取物和可浸出物)筛选案例
- 液相色谱(LC)用 [95636] 21种化合物(每种化合物50 μg/mL)溶于乙腈中;
- 气相色谱(GC)用E&L筛选标准 [01829] 14种化合物(每种化合物50 μg/mL)溶于叔丁基甲醚中(Irgafos是BASF的商标)。
美国药典(USP)<661.1>和欧洲药典(EP)3.1.13中列出的一些典型塑料添加剂可作为药物参考标准。根据ASTM标准D6042-96(专门用于聚丙烯测试)制备的含少量化合物的参考混合物也有提供。这类单独的参考化合物或ASTM混合物是为针对已知添加剂的材料特性表征而设计的,因此适用于目标方法,但不一定适用于筛选目的。
CRM混合液的制备的质量标准
我们对标准品或参考物质的基本要求是:尽可能最高的精确度,并且可以通过国家计量机构(NMI)颁发的一级校准器追溯至国际单位制(SI单位)。
图1 从研究用化学品到CRM和一级材料的不同质量级别,它们共同参与确保准确性和可追溯性。
化学品不同质量水平的文档和可追溯性(NIST = 美国国家标准与技术研究院,NRC = 国家研究委员会,ISO = 国际标准化组织)
CRM的开发和制备遵循ISO的流程,并使用经ISO/IEC-17025认证的分析方法。从混合物中不同组分的合成和纯化开始,到生成证书结束。如图2所示,从混合物中不同组分的合成和纯化开始,到生成证书。

图2 **经认证的参考物质(CRM)生成流程(LC = 液相色谱,GC = 气相色谱,MS = 质谱,IDMS = 同位素稀释质谱,qNMR = 定量核磁共振,wb = 瓶内,bb = 瓶间,AST = 加速稳定性测试,LTS = 长期稳定性)
认证方法
含量
为了准确确定CRM混合物中化合物的含量,我们使用了 直接法(Primary absolute)和比率方法(primary ratio methods)。
使用定量核磁共振(qNMR)光谱法来确证化合物的单个质量分数或含量(10, 11)。qNMR能够直接测量分析物与作为内标的主要参考物,从而获得认证的含量值和可追溯至SI单位的值(12)。
只要每个样品和参考物的单个NMR信号足够纯净,杂质不会影响此步骤的认证结果。
在对每种化合物进行qNMR测量后,将这些化合物溶解在适当的溶剂中并稀释至所需的最终浓度。根据ISO 17034的要求,对该重量稀释步骤和随后的安瓿瓶填充进行验证。
组分稳定性和均一性
由于 因为溶液中组分的浓度太低要确定混合物中化合物的稳定性和均一性,此时无法使用qNMR进行分析。需要采用经验证的色谱方法来测试。
我们使用验证过的色谱方法测试了随机选择的安瓿瓶内和瓶间的均一性。使用相同的分析方法来验证混合物中不同化合物的稳定性。
分析了每个混合物化合物在特定时间的浓度,并将结果与在-80°C下冷冻的样品进行了比较。
图3 最终可提取物和可浸出物筛选标准的稳定性测试结果
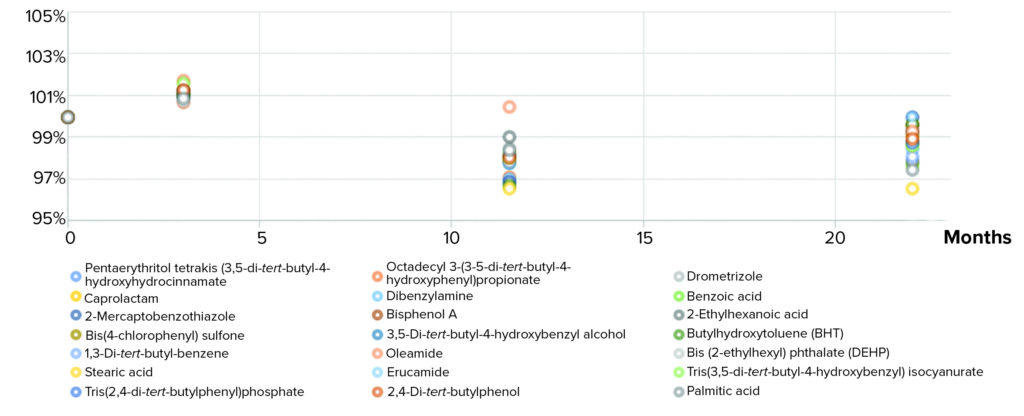 Figure 3: Stability test results of final extractables and leachables screening standard.
Figure 3: Stability test results of final extractables and leachables screening standard.
在参考混合物的首个配方原型测试中我们也发现了一些化合物不稳定,具体如下:
- bisphenol F diglycidyl ether (BFDGE, CAS 2095-03-6),是一种环氧树脂的常见单体。研究表明,BFDGE与混合物中的另一种化合物2-巯基苯并噻唑(2-MBT)发生了反应,导致形成了仲醇。
于是我们将BFDGE从混合物组分中剔除。
只有在控制、验证并确定了所有混合物化合物的均一性和稳定性之后,才能为整个混合物建立分析证书。该证书包括认证过程中的所有结果和计算:均一性、稳定性测试、具有相应不确定度范围的认证浓度、通过NMI的原材料可追溯至SI单位,以及固定的到期日期。该证书可以从供应商网站上下载。
分析化学中的方法验证和持续的质量控制取决于参考物质的适用性(16)。通常使用基质CRM来确定分析程序的偏差及其不确定性。由于目前市面上还没有塑料的基质CRM供应,因此,作为替代选择,需要实验室自己开发E&L筛选标准的CRM。
CRM的方法验证
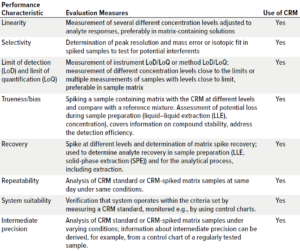
将一定水平的CRM加入有或无基质的测试样品中,即标准加入法。
使用该法配置的测试样品,可以用于评估分析方法或整个分析过程的各种参数。如线性、灵敏度和LoD/LoQ。也可以对分析的偏差进行评估,考察系统误差并监测随机误差。
表2:使用认证参照物(CRM)的分析方法验证参数;示例为液相色谱-高分辨率质谱(LC-HRMS)方法。
质量控制应用
CRM可用于
- 内部质量控制
包括分析系统适用性标准、参考物质、加标样品、重复样品和空白样品(18, 19)等,也可以作为标准品的替代品使用(20)。 - 外部质量控制 例如,能力验证以评估实验室之间的比对。
图5是典型的平均值控制图,CRM中BPA的浓度为10 µg/mL。说明可以通过参考混合物控制内部校准,发现实验室内部系统误差并控制随机误差。
图5:使用内部标准混合物进行校准的独立CRM中双酚A的平均值Shewhart控制图。

对于LC-MS分析系统,方法参数复杂且多种分析物的检测比GC-MS更困难。表3和表4列出了不同设备的分析和检测参数,可作为使用E&L筛选标准建立新LC-MS方法的参考。
表5:液相色谱-高分辨率质谱(LC-HRMS)对液相色谱中可提取物和可浸出物筛选标准的分析物的检测结果(ESI离子源)。加合物取决于所使用的系统。例如,如果仅在系统1中检测到[M+H]+加合物,则标记为[M + H]+ (1)”。
电喷雾电离(ESI)是目前所有LC-HRMS E&L筛选的首选技术,因为它适用于大多数具有可电离杂原子和功能的塑料添加剂。然而,ESI的一个缺点是电离效率的基质依赖性,这不仅可以导致离子抑制,还可以导致增强。
大气压电化学电离(APCI)在E&L实践中也有重要的作用,具体视各实验室的体系和习惯不同可作为另外的选择。
要注意不同品牌的高分辨质谱的参数一般是无法互相转移的,也没有参考价值。
表3和表4显示了用于分析CRM混合物的不同品牌的设备的详细信息。检测器有四极杆飞行时间质谱仪(QTof-MS)和UV-Vis检测器。检测波长 λ=220 nm,如果发色团与母体化合物相比没有变化,则UV信号可用于浓度的半定量估计(例如,添加剂的降解物或聚合物低聚物)(22)。
图6:LC系统2在异丙醇中1 μg/mL的萃取物和可浸出物筛选标准;记录了ESI正负电离模式的基峰离子色谱图和220 nm处的UV色谱图。通过UV和MS检测的组合,检测到了CRM的所有化合物。
总结
标准物质(CRMs)在分析化学中是产生准确和可靠测量结果的必不可少的手段。它们用于方法验证、系统适用性标准或校准。目前还没有可用于聚合物材料的可提取物筛选和可浸出物测试的标准物质。本文介绍了为液相色谱和气相色谱系统生成的E&L筛选标准的详细信息,以及如何在日常实验室工作中使用它。
参考资料
1 EU Guidelines for Good Manufacturing Practice for Medicinal Products for Human and Veterinary Use. EudraLex Volume 4, Good Manufacturing Guidelines Part I, Chapter 3. European Commission: Brussels, Belgium, 2014; https://ec.europa.eu/health/system/files/2016-11/chapter_3_0.pdf.
2 Code of Federal Regulations, Title 21, Part 221.65 — Equipment Construction. US National Archives: Washington, DC, 2017; https://www.ecfr.gov/current/title-21/chapter-I/subchapter-C/part-211/subpart-D/section-211.65.
3 <1663> Assessment of Extractables Associated with Pharmaceutical Packaging/Delivery Systems. USP 41–NF 16. US Pharmacopeial Convention: Bethesda, MD, 2018: 7910–7924.
4 Kruve A, et al. Tutorial Review on Validation of Liquid Chromatography–Mass Spectrometry Methods: Part 1. Anal. Chim. Acta 870, 2015: 29–44; https://doi.org/10.1016/j.aca.2015.02.017.
5 Bradley E, Coulier L. An Investigation into the Reaction and Breakdown Products from Starting Substances Used to Produce Food Contact Plastics. Report FD07/01, Project Number A03054, Food Standards Agency. US Department of Agriculture: Washington, DC, 2007; https://www.nal.usda.gov/research-tools/food-safety-research-projects/investigation-reaction-and-breakdown-products-starting.
6 Jenke D. Compatibility of Pharmaceutical Solutions and Contact Materials: Safety Assessments of Extractables and Leachables for Pharmaceutical Products. John Wiley & Sons, Inc.: Hoboken, NJ, 2009.
7 Piringer OG, Baner AL. Plastic Packaging: Interactions with Food and Pharmaceuticals. Wiley-VCH Verlag GmbH & Co.: Weinheim, Germany, 2008; https://doi.org/10.1002/9783527621422.
8 ISO 17034: 2016: General Requirements for the Competence of Reference Material Producers. ISO: Geneva, Switzerland; https://www.iso.org/standard/29357.html.
9 ISO/IEC 17025: 2017: General Requirements for the Competence of Testing and Calibration Laboratories. ISO: Geneva, Switzerland; https://www.iso.org/publication/PUB100424.html.
10 Nelson MA, et al. A New Realization of SI for Organic Chemical Measurement: NIST PS1 Primary Standard for Quantitative NMR (Benzoic Acid). Anal. Chem. 90(17) 2018: 10510–10517; https://doi.org/10.1021/acs.analchem.8b02575.
11 Weber M, et al. Using High-Performance Quantitative NMR (HP-qNMR) for Certifying Traceable and Highly Accurate Purity Values of Organic Reference Materials with Uncertainties <0.1%. Accredit. Qual. Assur. 18(2) 2013: 91–98; https://doi.org/10.1007/s00769-012-0944-9.
12 Metrological Traceability in Analytical Measurement. 2nd ed. Ellison SLR, Williams A, Eds. Eurachem/Cooperation on International Traceability in Analytical Chemistry (CITAC), 2019.
13 Bedson P. Guidelines for Achieving High Accuracy in Isotope Dilution Mass Spectrometry (IDMS). The Royal Society of Chemistry, London, UK, 2002; https://doi.org/10.1039/9781847559302.
14 Vogl J, Pritzkow W. Isotope Dilution Mass Spectrometry — A Primary Method of Measurement and Its Role for RM Certification. J. Metrol. So. India 25(3) 2010: 135–164; https://doi.org/10.1007/s12647-010-0017-7.
15 Quantifying Uncertainty in Analytical Measurements. 3rd ed. Ellison SLR, Williams AJ, Eds. Eurachem/CITAC, 2018: https://www.eurachem.org/images/stories/Guides/pdf/QUAM2012_P1.pdf.
16 The Fitness for Purpose of Analytical Methods: A Laboratory Guide to Method Validation and Related Topics. 2nd ed. Eurachem, 1998; https://www.eurachem.org/images/stories/Guides/pdf/MV_guide_2nd_ed_EN.pdf.
17 Ellison, SLR, Barwick VJ, Farrant, TJD. Practical Statistics for the Analytical Scientist: A Bench Guide. The Royal Society of Chemistry, London, UK, 2009; https://doi.org/10.1039/9781847559555.
18 Emons H, Held A, Ulberth F. Reference Materials as Crucial Tools for Quality Assurance and Control in Food Analysis. Pure Appl. Chem. 78(1) 2006: 135–143; https://doi.org/10.1351/pac200678010135.
19 Guide to Quality in Analytical Chemistry: An Aid to Accreditation. Eurachem/CITAC 2016; https://www.eurachem.org/images/stories/Guides/pdf/Eurachem_CITAC_QAC_2016_EN.pdf.
20 ISO GUIDE 80:2014 Guidance for the In-House Preparation of Quality Control Materials (QCMs). ISO: Geneva, Switzerland; https://www.iso.org/standard/44313.html.
21 Norwood DL, et al. Safety Thresholds and Best Practices for Extractables and Leachables in Orally Inhaled and Nasal Drug Products. PQRI Parenteral and Opthalmic Drug Product Leachables and Extractables Working Group: Washington, DC, 2006; https://pqri.org/wp-content/uploads/2020/10/PQRI-PODP-Extractables-and-Leachables-Update_9Sept2020_FINAL.pdf.
22 Schaefer A, Ohm VA, Simat TJ. Migration from Can Coatings: Part 2 — Identification and Quantification of Migrating Cyclic Oligoesters Below 1,000 Da. Food Addit. Contam. 21(4) 2004: 377–389; https://doi.org/10.1080/02652030310001637939.