春节假期已落下帷幕,对于制药行业的同仁们而言,了解并掌握最新的法规政策变动至关重要。本文特此整理了近期值得制药人学习的法规政策动态,以供大家参考。
2月4号,国家药监局药品评审中心发布2023年度药品审评报告
报告显示:2023年,药品注册申请受理量和审结量均创近五年新高,药审中心受理各类注册申请同比增加35.84%,审结注册申请同比增加28.80%。全年批准上市创新药40个品种,新批准罕见病用药45个品种,批准儿童用药产品92个品种,临床用药需求更好得到满足。
FDA 2023年新药年度报告
与此同时,我们也注意到2024年1月,美国食品药品监督管理局(FDA)正式发布了2023年新药年度报告。报告显示,药品评价与研究中心(CDER)的中位数审批时间稳定地保持在11个月左右。相较于前几年,2022和2023年的审批时间确实发生了显著变化,这反映出全球药品审评领域正面临着新的挑战和机遇。
值得一提的是,在2015至2021年期间,平均每年有14%的药品申请审评时间少于6个月,这比优先审评的目标时间提前了至少两个月。CDER在2023年共批准了55种创新疗法,相较于2022年的新药批准数量增长了近50%。
2月4号到8号,国家药监局药品评审中心指导原则七联发
- 《抗体偶联药物药学研究与评价技术指导原则》的通告(2024年第14号)
- 《微型片剂(化学药品)药学研究技术 指导原则(试行)》的通告(2024年第13号
- 《药物研发与技术审评沟通交流会议申请资料参考》的通知(2024年第48号
- 《药品注册研发生产主体合规信息管理与审查指导原则(试行)》的通告(2024年第12号)
- 关于公开征求《濒危动物类中药材人工制成品研究技术指导原则(征求意见稿)》和《替代或者减去已上市中药处方中濒危药味研究技术指导原则(征求意见稿)》意见的通知
- 《放射性化学仿制药药学研究技术指导原则》的通告(2024年第11号)
- 《化学药改良型新药临床药理学研究技术指导原则(试行)》的通告(2024年第10号)
2月18号,ICH Q2(R2)/Q14 实施建议和中文版意见
2月18号,国家药监局药品评审中心公开征求 ICH《Q2(R2)/Q14:分析方法验证和分析方法开发》实施建议和中文版意见。

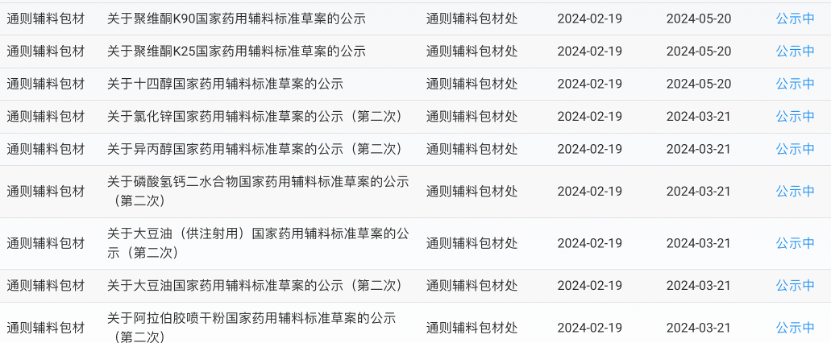
2月19号,国家药典委员会公示国家药用辅料标准草案
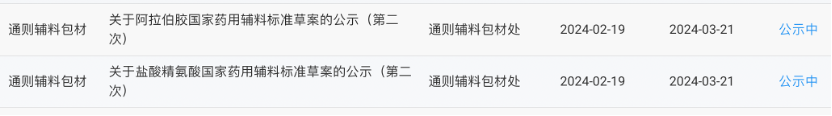
2月19日,国家药典委员会公示聚维酮K90、聚维酮K25、氯化锌、大豆油(供注射用)、阿拉伯胶等11个国家药用辅料标准草案。其中3个标准草案为首次公示,公示期三个月。另8个标准草案为第二次公示,公示期为一个月。
公示目录如下:
-
聚维酮K90国家药用辅料标准草案
-
聚维酮K25国家药用辅料标准草案
-
十四醇国家药用辅料标准草案
-
氯化锌国家药用辅料标准草案(第二次)
-
异丙醇国家药用辅料标准草案(第二次)
-
磷酸氢钙二水合物国家药用辅料标准草案(第二次)
-
大豆油(供注射用)国家药用辅料标准草案(第二次)
-
大豆油国家药用辅料标准草案(第二次)
-
阿拉伯胶喷干粉国家药用辅料标准草案(第二次)
-
阿拉伯胶国家药用辅料标准草案(第二次)
-
盐酸精氨酸国家药用辅料标准草案(第二次)
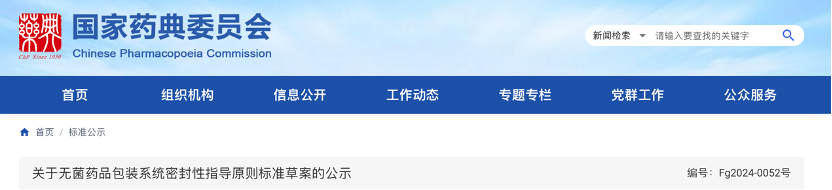
2月19号,国家药典委发布2项药包材指导原则标准草案
- 无菌药品包装系统密封性指导原则标准草案
- 药包材生物学评价与试验选择指导原则标准草案
制药行业的同仁们应密切关注国内外法规政策的最新动态,及时调整企业战略和生产流程以适应市场需求和法规要求。同时,也希望相关部门能够继续加强法规政策的制定和完善工作,为制药行业的健康发展提供有力保障。