引言
药品质量安全是医药行业的核心议题,其中亚硝胺杂质的控制尤为关键。自2018年缬沙坦事件以来,美国食品药品监督管理局(FDA)持续加强对亚硝胺杂质的监管,并于2023年8月发布了“亚硝胺类药物相关杂质(NDSRI)推荐可接受摄入量限度行业指导原则”(以下简称“指导原则”),为制药企业提供了更为明确的监管框架。

一、指导原则出台背景
FDA于2023年发布的该指导原则并非横空出世,而是对先前监管实践的总结与深化。此前,FDA已发布《人用药品亚硝胺杂质控制行业指导原则》,但主要针对工艺过程、降解途径及污染引入等途径产生的亚硝胺杂质,未涉及NDSRI。
随着对亚硝胺研究的不断深入,FDA意识到一类与原料药结构相似的亚硝胺——NDSRI同样具有潜在风险。NDSRI通常由药物制剂中含有仲胺或叔胺结构的API在接触亚硝化剂时形成。由于NDSRI缺乏充分的致癌性和致突变性试验数据,无法直接确定可接受摄入量限度(AI)。
为解决这一难题,FDA发布《Recommended Acceptable Intake Limits for Nitrosamine Drug Substance-Related Impurities Guidance for Industry》,旨在提供一种基于结构特征预测NDSRI致癌潜力的方法,并据此确定AI限度。
二、指导原则核心内容解读
该指导原则的核心在于提供了一种基于风险的安全性评估方法,帮助制药企业预测药品中可能存在的NDSRI的致突变性和致癌性潜力,并据此确定AI限度。
该指导原则具体内容包括:
-
明确适用范围:
指导原则适用于已批准或待批准的新药注册申请(NDA)、仿制药注册申请(ANDA),以及未通过药品申请而销售的产品。同时,也适用于临床开发中的处方药和非处方药,以及含有化学合成片段的生物制品或含有药物成分的生物主导组合产品。 -
重申风险评估的重要性:
FDA建议对NDSRI进行基于风险的安全性评估,生产企业可结合该指导原则及《人用药中亚硝胺杂质控制行业指导原则》的建议,确定制剂和原料药中NDSRI的AI限度。 -
结构特征预测致癌潜力(CPCA):
指导原则的核心在于利用NDSRI的结构特征预测其致癌潜力类型。由于对N-硝基化合物的结构-活性关系(SAR)研究已取得一定进展,FDA建议使用预测方法评估NDSRI的致癌性,并更准确地预测其致突变潜力,进而对不同致癌性分类的NDSRI推荐不同的AI限度。 -
明确AI限度确定方法:
在AI限度水平下,保守假设人一生(70年)中每日都暴露于该杂质,每10万人中会增加1例患癌症风险。
FDA建议根据已发表的科学文献中啮齿类动物致癌性数据计算,如TD50值(该剂量下导致肿瘤发生率达到50%,相当于癌症风险概率1/2)。
当NDSRI的致突变性没有得到充分表征时,FDA和申请人支持使用定量(Q)SAR方法确定一种经可靠方法检测过的替代化合物(其结构和反应性与NDSRI相似)以此预估致癌性,根据此方法也可以得到具有科学性的 AI 限度。 -
提供预测致癌性潜力分类方法(CPCA):
该指导原则推荐了一种可根据NDSRI的激活和失活结构特征预测 NDSRI 的致癌性分类从而确定AI 限度的方法。提出了基于结构的致癌性潜力分类方法(CPCA),是对 ICH M7(R2)中提供方法的补充。该方法参考了近年来文献发表的亚硝胺化合物 SAR 概念。
三、预测致癌性潜力分类方法(CPCA)详解
为更好地理解指导原则,以下将对CPCA方法进行详细解读:
CPCA基本原理
CPCA方法基于结构-活性关系(SAR)原则,通过识别NDSRI分子中的激活和失活结构特征,预测其致癌潜力。激活结构特征指能够增加NDSRI致癌性的分子亚结构,例如α-羟基化代谢激活机制。失活结构特征则指能够降低NDSRI致癌性的分子亚结构。
CPCA适用范围
CPCA方法适用于N-亚硝胺基团两侧结合一个碳原子的NDSRI,且这些碳原子不直接通过双键与杂原子连接。此外,该方法不适用于N-亚硝胺基团在芳香环结构内的NDSRI。
CPCA具体步骤
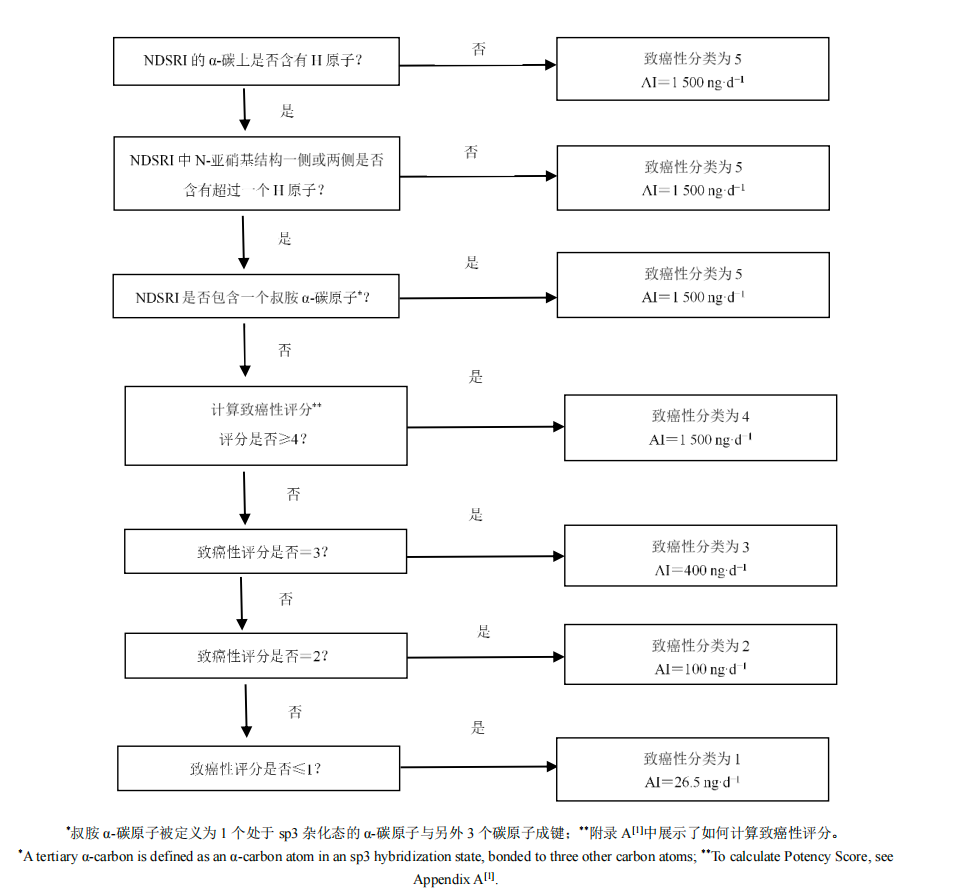
- 评估α-碳和β-碳:首先,确定NDSRI分子中与N-亚硝胺基团相连的α-碳和β-碳。
- 判断α-碳上是否含有H原子:如果α-碳上不含H原子,则该NDSRI的致癌性分类为5类,AI限度为1500 ng/d。
- 判断N-亚硝基结构一侧或两侧是否含有超过一个H原子:如果N-亚硝基结构一侧或两侧含有超过一个H原子,则该NDSRI的致癌性分类为5类,AI限度为1500 ng/d。
- 判断是否包含叔胺-碳原子:如果包含一个叔胺-碳原子,则计算致癌性评分。
- 计算致癌性评分:根据分子中存在的激活和失活结构特征,计算致癌性评分。
- 根据致癌性评分确定AI限度:根据致癌性评分,将NDSRI分为1-4类,并确定相应的AI限度。
四、不同致癌性分类对应的AI限度
根据CPCA方法,NDSRI可被分为五类,每类对应不同的AI限度:
- 第1类:基于致癌性最强、经可靠测试的亚硝胺(NDEA)的类别特异性限度确定,AI限值为26.5 ng·d-1。
- 第2类:推荐的 100 ng·d-1的AI限度代表了2种强效的、经可靠测试的亚硝胺,即 N-亚硝基二甲胺(NDMA)和4-(甲基亚硝胺)-1-(3-吡啶)-1-(丁酮)(NNK),这2种亚硝胺推荐的AI限度分别为96 ng·d-1和100 ng·d-1。
- 第3类:与2类致癌性分类相比,这一类NDSRI 具有较弱的致癌性,这主要是源于它们化学结构中存在较弱的失活结构特征,AI限度为400 ng·d-1。
- 第4类:归类为第4类的NDSRI可能通过α羟基化途径代谢激活产生活性致癌代谢物,但预计其致癌性较低,例如,由于位阻效应或电子效应,活化通路受阻或者活化前被清除。根据 ICH M7(R2)的毒理学关注阈值(TTC),建议AI限值为1500 ng·d-1
–第5类:归类为第5类的NDSRI由于空间位阻或缺乏α-氢,预计不会通过α-羟基化途径代谢激活,或者预测产生的代谢物不稳定,无法与DNA 发生反应。根据 ICH M7(R2)的TTC,建议的AI限度为1500 ng·d-1。
图 1 预测 NDSRI 致癌性分类并确定相关推荐 AI 限度的流程图
五、NDSRI 的推荐实施时间线
FDA对NDSRI的实施时间线根据药品的监管状态有所区分:
对于已批准或上市药品:
- 风险评估:建议在指导原则发布后3个月内(即2023年11月1日前)重新评估风险。
- 确证性检测:一旦确定NDSRI的风险,应尽快采用灵敏且经过适当验证的方法进行确证性检测,对于具有高风险的药品应立即进行确证性检测。
- 提交变更:在2025年8月1日前完成药品NDSRI确证性检测,同时在药品申请时提交必要变更。至2025年8月1日,确保其药品中NDSRI符合 FDA 推荐的 AI 限度要求。
- 根本原因调查和变更实施:实施时间线包括调查 NDSRI 杂质产生的根本原因,确定适当的有效变更(例如,变更生产工艺、成分供应商、制剂处方等),并证明变更将尽可能减少 NDSRI 的产生而不会对药品质量产生不利影响。
对于正在研究和正在审评过程中的药品:
- 提交前阶段:FDA 建议申请人在提交首次申请之前,应对NDSRI进行风险评估,并酌情进行确证性检测。如果在首次申请提交时尚未完成风险评估及确证性检测(如适用),且未提交药物主文件(DMF)变更或申请变更,上述材料可以通过修正案形式提交。
- 待 FDA 审评的申请:待审品种的申请人应尽快对产品进行风险评估,并在确证性检测发现NDSRI 水平高于该指南推荐的AI 限度时通知FDA。如果检测到的 NDSRI 水平超过推荐的AI 限度,申请人应酌情修订申请。
六、结语
FDA的该指导原则是对亚硝胺杂质管控的进一步完善,为制药企业提供了更清晰的指导。国内制药企业应充分理解并应用该指导原则,采取有效的风险评估和控制措施,确保药品质量安全,保障患者用药安全。
参考文献
[1] FDA. Recommended Acceptable Intake Limits for Nitrosamine Drug Substance-Related Impurities Guidance for Industry.
2 陈美灵等,FDA“亚硝胺类药物相关杂质推荐可接受摄入量限度行业指导原则”的介绍和启示,药物评价研究,第 48 卷第6期2025年6月









