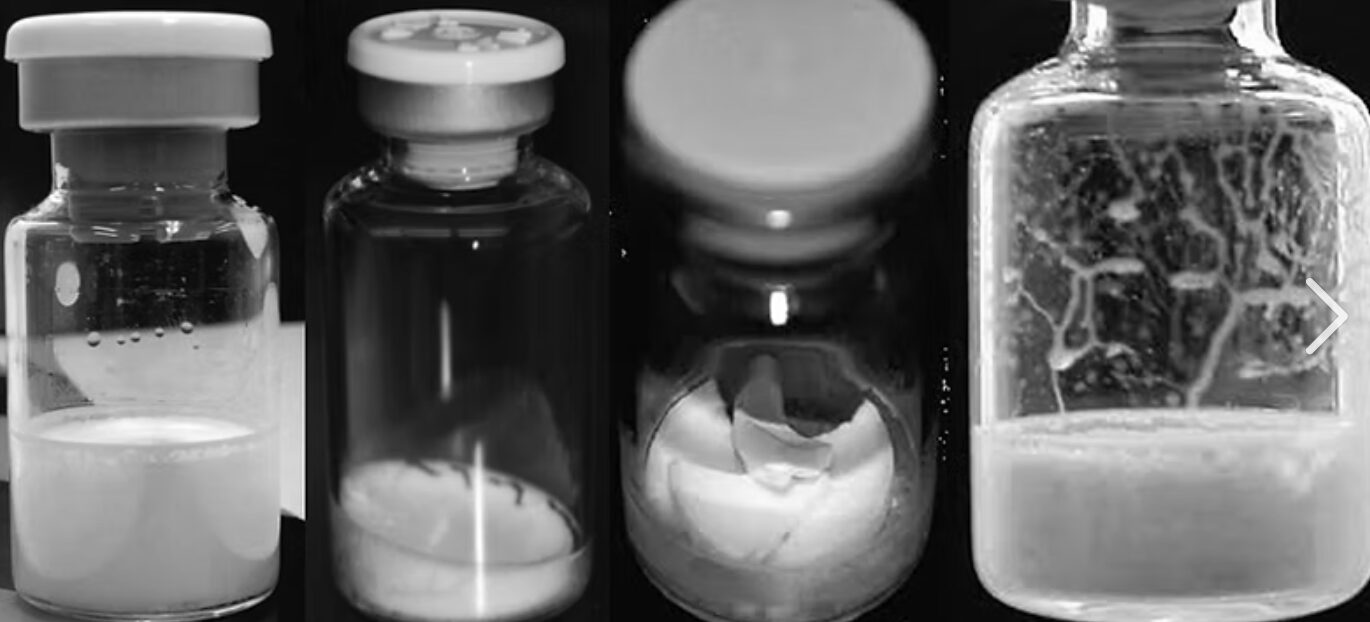
在生物制药的产业链条中,真空冷冻干燥(Lyophilization)可保护不稳定生物大分子。然而,在实际生产中,研发与生产团队常被两种典型的物理缺陷所困扰:一是药液沿瓶壁攀爬形成的“爬壁(Creeping)”现象,二是干燥后药饼结构断裂形成的“破碎(Cracking)”现象。
这两者虽表现为外观缺陷,但其本质是药液配方、冻干工艺参数与药用包装材料内表面之间界面相互作用(Interfacial Interaction)的失衡。
随着自动化灯检(AVI)技术的普及和对制剂稳定性要求的提升,传统的“容器思维”已难以应对高价值生物制剂的挑战。本文将深入探讨这两类现象的底层机理,并重点分析如何通过药包材的功能化设计,从根源上降低质量风险。
第一章 爬壁现象:微观界面应力驱动
1.1 爬壁现象的物理本质:毛细驱动与张力梯度
爬壁现象并非简单的液面晃动,而是在预冻前及预冻初期,药液沿西林瓶内壁向上攀升,干燥后留下薄膜、白点或环状结晶。其形成核心在于三相接触线(Triple-phase line)的失控。
-
高表面能驱动的强亲水润湿:
中性硼硅玻璃内表面含有大量的硅羟基(-OH),这使得玻璃表面具有极高的表面能(Surface Energy)。当极性较强的药液(尤其是含有大量自由水的生物制剂)注入时,瓶壁展现出强亲水性。毛细力作用于瓶壁与药液的弯月面,为其向上攀升提供了初始动力。
-
马兰戈尼效应(Marangoni Effect)的助推:
生物制品中通常加入聚山梨酯80/20等表面活性剂。在预冻过程中,水分开始结冰,导致局部溶质浓度升高。这种浓度的不均匀引发了表面张力梯度,从而驱动液体从低表面张力区向高表面张力区移动,导致溶质沿瓶壁进一步“爬升”。 -
冷冻浓缩效应的“锁定”作用:
随着温度降低,未冻结的药液浓缩成高黏度状态。若瓶壁存在微观粗糙度或化学不均一性,这些高浓缩溶质会被“锁定”在瓶壁上,随着水分升华,最终固化为爬壁残留。
1.2 爬壁对产品质量的深层损害
-
误剔率与生产经济性: 爬壁形成的薄雾常被AVI系统识别为可见异物或容器密封性缺陷(CCI风险)。对于单价数万元的单抗药物,3%的误剔率即意味着巨大的商业损失。
-
活性成分(API)的降解风险: 爬附在瓶壁上的薄膜由于缺乏药饼主体结构的保护,在干燥过程中脱水过度且直接暴露于解析干燥的高温下,极易发生蛋白变性。复溶后,这些变性蛋白进入主药液,可能诱发免疫原性风险。
-
剂量的“微量蒸发”:爬壁部分的药物在复溶时极难被完全溶解。对于ADC、单抗等高价值药物,每一微克的流失都是对药效准确性的挑战。
第二章 药饼破碎:热应力失衡与结构强度的崩塌
2.1 破碎现象的成因:应力集中的必然结果
理想的冻干饼应呈现疏松多孔的均一结构,但实际生产中常见的开裂、掉块或整体粉碎,其核心矛盾在于收缩应力超过了材料强度。
-
界面粘附力的“锚定效应”:
在升华阶段,药饼会因水分脱离产生体积收缩。若西林瓶内壁与药饼之间的粘附力过强,药饼在收缩时就像被牢牢“钉”在瓶壁上。当内部收缩力无法释放,应力便会在药饼薄弱处集中,导致径向或环向裂纹。 -
传热不均引发的温差应力:
由于传统西林瓶瓶底的凹陷设计,热量从层板向瓶底的传递主要依靠辐射和微弱的接触传热。这种不均匀的传热(传热系数Kv的不一致)导致药饼底部与中上部存在显著温差梯度。不同温区的膨胀系数差异,在药饼内部种下了破碎的“种子”。 -
逸气阻力与结壳效应:
预冻阶段若表面降温过快,可能形成致密的冰晶层(结壳)。在升华阶段,内部水蒸气逸出受阻,内压骤增,最终冲破表面壳层,造成药饼顶层的坍塌或喷瓶。
2.2 破碎对临床应用的影响
破碎的药饼会导致复溶时间显著延长,且破碎产生的微屑在抽取药液时可能堵塞针头或产生非预期微粒。对于临床医护而言,药饼的完整性直接关联到对药品质量的第一直觉。
第三章 核心解决方案:药包材的选择与多维度优化
面对爬壁与破碎,工艺优化(如调整预冻速率、升华压力)固然重要,但包材的选择往往能起到“拨乱反正”的底层支撑作用。现代药用玻璃技术已从“惰性容器”转向“功能性界面设计”。
3.1 表面能调控:疏水涂层技术的革命性应用
针对爬壁现象,最根本的策略是将玻璃的“亲水受液面”改造为“疏水排液面”。
- 疏水内表面处理(如肖特EVERIC® lyo系列):
采用物理气相沉积(PVD)或等离子体增强化学气相沉积(PECVD)技术,在玻璃内表面键合一层极薄且高度稳定的高度疏水层。 - 消除爬壁的机制:
疏水涂层使药液与瓶壁的接触角显著增大(通常从亲水状态提升至90°以上)。药液在瓶内呈现“荷叶效应”,无法形成攀爬所需的弯月面。实验数据表明,使用疏水西林瓶后,爬壁相关的灯检剔除率可降低至接近于零。 - 协同降低破碎风险:
疏水表面不仅排斥液体,还显著降低了干饼与瓶壁的粘附系数。在收缩过程中,药饼能与瓶壁实现“平滑脱离”而非强行拉扯,从而有效缓解了内部应力集中,降低了开裂概率。
3.2 热传递动力学优化:瓶底平面度的微米级管控
热量传递的效率与均一性(Kv值)直接决定了冻干饼的结构一致性。
- 近扁平瓶底(Near-Flat Bottom)设计:
传统西林瓶底部的“拱形”高度通常在0.5mm-0.8mm之间,这在真空下形成了巨大的热阻。优化后的平整瓶底能显著增加与冻干机层板的实际接触面积。通过高精度成型模具,将瓶底凹陷度控制在极窄的公差范围内(例如从0.5mm压缩至0.1mm以内)。这种设计使瓶底与层板的接触面积提升了3-5倍。
热流密度均一化: 均匀的接触确保了热量能从中心向边缘同步传递,极大地降低了药饼内部的径向温差。
缓解“边际效应”: 在冻干机的边缘位置,由于热辐射不均,破碎率通常更高。高平整度瓶底提供的稳定导热能有效补偿辐射差异,提升批次内的外观一致性。-
- 优化传热系数(Kv):
平整瓶底使传热从以“热辐射”为主转变为以“接触传热”为主,传热效率可提升20%-30%。更重要的是,它缩小了同一批次、不同位置西林瓶之间的热传导差异,使所有药饼经历几乎相同的热历史,从物理层面减少了因温差应力导致的破碎。 - 对缩短周期的贡献: 高效的传热意味着可以在更短的时间内完成主升华,在降低破碎风险的同时提升了产线产能。
3.3 玻璃化学稳定性与表面均一性
玻璃表面的化学缺陷往往是爬壁的隐性诱因。
-
控制碱金属析出与pH波动:
劣质中性硼硅玻璃在成型过程中,瓶底和肩部易产生硼、钠离子的富集。这些离子在药液浸泡过程中析出,改变了局部区域的pH值和离子强度,进而影响了药液在该区域的张力特性。选择高水解抗性的玻璃材质(如一级中性硼硅玻璃),并采用受控的退火工艺,能确保表面化学性质的均一,消除诱发爬壁的化学“陷阱”。
- 防脱片(Delamination)处理:
玻璃表面的微观脱片会产生极大的表面积,为溶质结晶提供核心。通过优化成型温度与模具润滑,减少玻璃表面的应力区,能防止微观脱片导致的界面特性改变。
3.4 几何尺寸与壁厚均一性
- 壁厚分布(Side Wall Thickness):
西林瓶壁厚的不均会导致预冻过程中径向降温速率的不对称。这种不对称会使冰晶生长方向发生偏移,造成药饼内部结构的物理性扭曲。高精度的管式成型工艺能确保壁厚极差控制在微米级,从而保障冷冻波前的均匀推进。 - 机械强度与抗冲击处理:
在冻干下料和旋盖环节,机械碰撞可能给已经存在微裂纹的药饼带来“临门一脚”。采用外壁低摩擦处理(如康宁Valor®玻璃)能减少瓶间碰撞力,间接保护了脆弱的干燥药饼结构。
第四章 深度适配策略:如何根据产品特性选择包材
药包材的选择并非“越贵越好”,而应基于QbD(质量源于设计)理念,结合药物配方进行科学适配。
4.1 针对高表面活性配方的策略
- 风险点: 若配方中含有高浓度的聚山梨酯或由于蛋白浓度极低导致表面张力极小。
- 最优选择: 强疏水涂层西林瓶是唯一可靠的选择。此类产品应重点考察涂层在冻干循环中对极端温度循环的耐受性。
4.2 针对高溶质含量、高Tg配方的策略
- 风险点: 如某些高浓度人血白蛋白制剂,其药饼坚硬但收缩应力巨大。
- 最优选择: 侧重于瓶底平整化设计与内壁中度疏水化的结合。平整瓶底确保底层干得透,不产生局部潮解;疏水内壁确保药饼不因“挂壁”而撕裂。
4.3 针对低浓度、易降解生物制剂的策略
- 风险点: 对pH极其敏感,微量的玻璃成分浸出即可能诱发蛋白聚集。
- 最优选择: 高化学稳定性、防脱片特性的顶级中性硼硅瓶。此类包材应经过严格的加速老化与浸出物研究,确保在整个货架期内界面特性的稳定。
五、总结
通过深入理解界面物理学机理,我们可以看到,药用包装材料不再仅仅是静止的容器,而是深度参与冻干动力学过程的功能性载体。选择具有疏水涂层、高平面度、高化学稳定性的先进药包材,不仅能从根源上降低爬壁与破碎的风险,更是企业提升制剂稳定性、优化生产效率、建立品牌高端形象的核心路径。