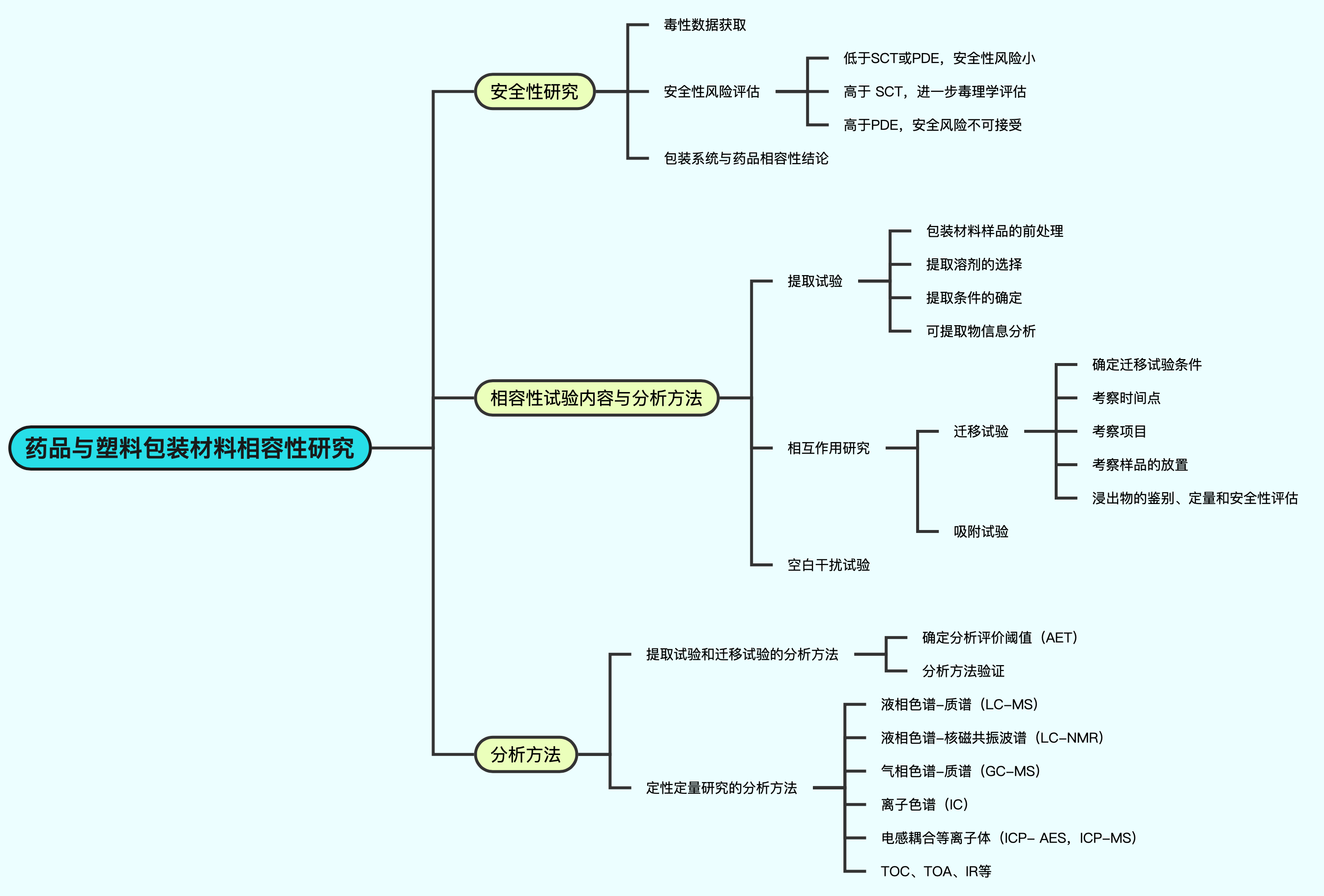
化学药品注射剂与塑料包装材料相容性研究主要包括提取试验、相互作用研究和安全性评价。
提取试验主要针对包装材料进行,通过提取试验可以评估包装材料中的可提取物。相互作用研究包括迁移试验和吸附试验,用于研究包装材料对药品的迁移和吸附情况。
安全性评价根据提取试验和迁移试验的结果,评估浸出物和可提取物的安全性风险。最后,根据相容性研究的结果,确定包装系统是否与药品具有相容性。
相容性研究的目的
评估药品与包装材料之间是否存在相互作用,以及这种相互作用是否会对药品的有效性、稳定性和安全性产生影响。其目的是确保包装材料与药品具有良好的相容性,不会引入可引发安全性风险的浸出物
相容性研究的步骤
- 确定直接接触药品的包装组件;
- 了解或分析包装组件材料的组成、接触方式和条件;
- 进行提取试验,初步评估可提取物的风险并预测潜在的浸出物;
- 进行相互作用研究,包括迁移试验和吸附试验;
- 对浸出物进行安全性评估;
- 总结药品与包装材料的相容性。
提取试验
目的是通过在较剧烈的条件下使用适宜的溶剂对包装材料进行提取,初步评估可提取物的风险并预测潜在的浸出物。
相互作用研究
迁移试验的条件和方法
迁移试验是用于考察从包装材料中迁移并进入制剂中的物质,以及这些物质对药品质量和安全性的影响
吸附试验的条件和方法
吸附试验则是考察包装材料对药品中活性成分或辅料的吸附程度,以及这种吸附是否会导致药品质量的改变。
结果分析与安全性评价
浸出物和可提取物的安全性风险评估可以通过比较其浓度与人每日允许最大暴露量(PDE)或安全性阈值(SCT)来进行。
如果浸出物或可提取物的浓度低于PDE或SCT,则认为其安全性风险较小;如果浓度高于PDE,则建议更换包装材料;如果浓度介于PDE和SCT之间,则需要进行进一步的安全性评估。