为了生产安全有效的药品,无菌灌装操作至关重要。安全的药品必须保证不含有微生物、颗粒物等污染物。
在无菌生产过程中,首先需要卸载小瓶并进行清洗,以去除颗粒并降低一定程度的生物负载。接着,对小瓶进行干热处理,以彻底消除任何残留的微生物污染。然而,为何灭菌后需要第二次加热小瓶呢?
这是因为,虽然灭菌能够确保玻璃瓶表面没有任何活的微生物,但无菌并不等同于可以安全使用的容器。残留在灭菌表面上的亚细胞成分,被称为“热原”,仍可能引发从轻度发烧到致命的感染性休克的生物反应。因此,必须采取多种措施来最大限度地减少热原负荷,实现玻璃瓶去热原的过程原则上简单易行,详见下文内容。
定义
中国药典:热原(pyrogen)定义为指能引起恒温动物体温异常升高的致热物质,包括细菌性热原、内源性高分子热原、内源性低分子热原及化学热原等。
注射液中的热原主要是指细菌性热原,是某些细菌的代谢产物、细菌尸体及内毒素。致热能力最强的是革兰氏阴性杆菌的产物。
USP <1228>:将去热原定义为直接且经过验证的热原破坏或去除过程。“去热原”是指破坏或去除细菌内毒素,细菌内毒素是最普遍且可量化的热原,可能作为胃肠外制剂中的污染物被发现。
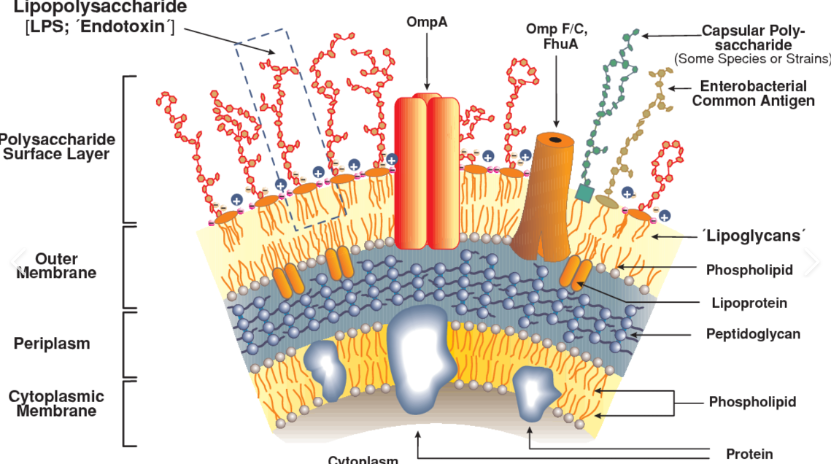
其中,内毒素是革兰氏阴性菌外细胞膜的成分,已知会引起人类和其他哺乳动物的发热反应,当内毒素通过消化道进入人体时并不产生危害,但若通过注射等方式进入血液则会引起不同的疾病。
热源的危害
脂多糖(LPS)是内毒素复合物的生物活性部分,是一种两亲性分子。LPS 激活TLR4 (类Toll 受体)会引发一系列复杂的生化反应,导致炎症反应并调动我们的免疫系统来对抗感知到的感染。这种反应的强度取决于检测到的LPS的量。如果药品或医疗设备被高浓度的内毒素污染,即使在无菌状态下,也可能在全身水平产生强烈的、不受控制的炎症反应,从而导致组织损伤、血压下降甚至死亡。
去热源的方法
-
<1228.1> “干热去热原”
主要通过焚烧来灭活热稳定材料上的内毒素,取决于四个基本参数:运行时间、运行温度、负载配置以及合格/校准设备的使用。典型的去热原过程在约170°C至约400°C之间的温度下进行。通常 -
<1228.3> “过滤除热原”
包括以下过滤和层析方法:微孔膜过滤、反渗透、超滤、电荷改性深层过滤器(内毒素和LPS带负电荷)和膜吸附器(离子交换层析)。 -
<1228.4> “通过冲洗去热原”
用热高纯水冲洗是消除内毒素活性的最常见方法,必须严格控制许多变量才能确保成功:- 冲洗水必须始终保持高质量,并且内毒素含量必须低。最常用的是注射水 (WFI)
- 水温很重要(>60°C)
- 必须确定负载大小
- 冲洗后,材料在使用或储存前必须干燥
- 所有设备和流程必须经验证
需要注意的是,去热原并不是一个“一刀切”的过程。必须开发经过验证的流程来涵盖预期的容器格式范围,这反过来又会影响控制内毒素灭活的热负荷和传热行为。
去热源对玻璃耐受性的影响
Ditter 等人建立了一种新型的三维激光扫描显微镜方法,采用系列常规和分析技术对玻璃瓶内表面进行分析,证明了玻璃瓶的洗涤和除热原处理都会影响未涂层玻璃瓶的表面特性,从而增加玻璃脱层的风险。因此在药品生产过程中,需要对除热原前残留水进行充分的研究和控制,以最小化表面地形的变化。
总结
无菌药品生产对安全性的要求极高,其中去除热原是保障药品安全不可或缺的一环。热原作为潜在的污染物,可能引发严重的生物反应,对患者健康构成威胁。
因此,在无菌生产过程中,必须采取有效措施彻底去除热原,如干热处理、过滤和冲洗等方法。同时,还需要密切关注这些方法对玻璃容器的影响,确保整个生产过程的无菌性和安全性。
参考文献
-
Parenteral Drug Association. 2013. Technical Report 3, “Validation of Dry Heat Processes Used for Depyrogenation and Sterilization
-
Dominique Ditter, Hanns-Christian Mahler etc., Impact of Vial Washing and Depyrogenation on Surface Properties and Delamination Risk of Glass Vial,Pharm Res.2018 May 23;35(7):146.
-
USP <1228> Depyrogenation
-
USP <1228.1> Dry Heat Depyrogenation
-
USP <1228.3> Depyrogenation by Filtration
-
USP <1228.4>, Depyrogenation by Rinsing