本文将以 USP <1661>《药用塑料包装系统及其材料的用户安全性影响评估》为核心,结合 USP <661>、<661.1>、<661.2> 等相关章节,深入探讨药用塑料包装系统的安全评估方法、合规要求和落地实践。
药品包装,尤其是塑料包装系统,直接关系到药品的质量、安全和疗效。如何确保塑料包装系统在生产、运输、储存和使用过程中不会对药品产生不利影响,甚至威胁患者安全?
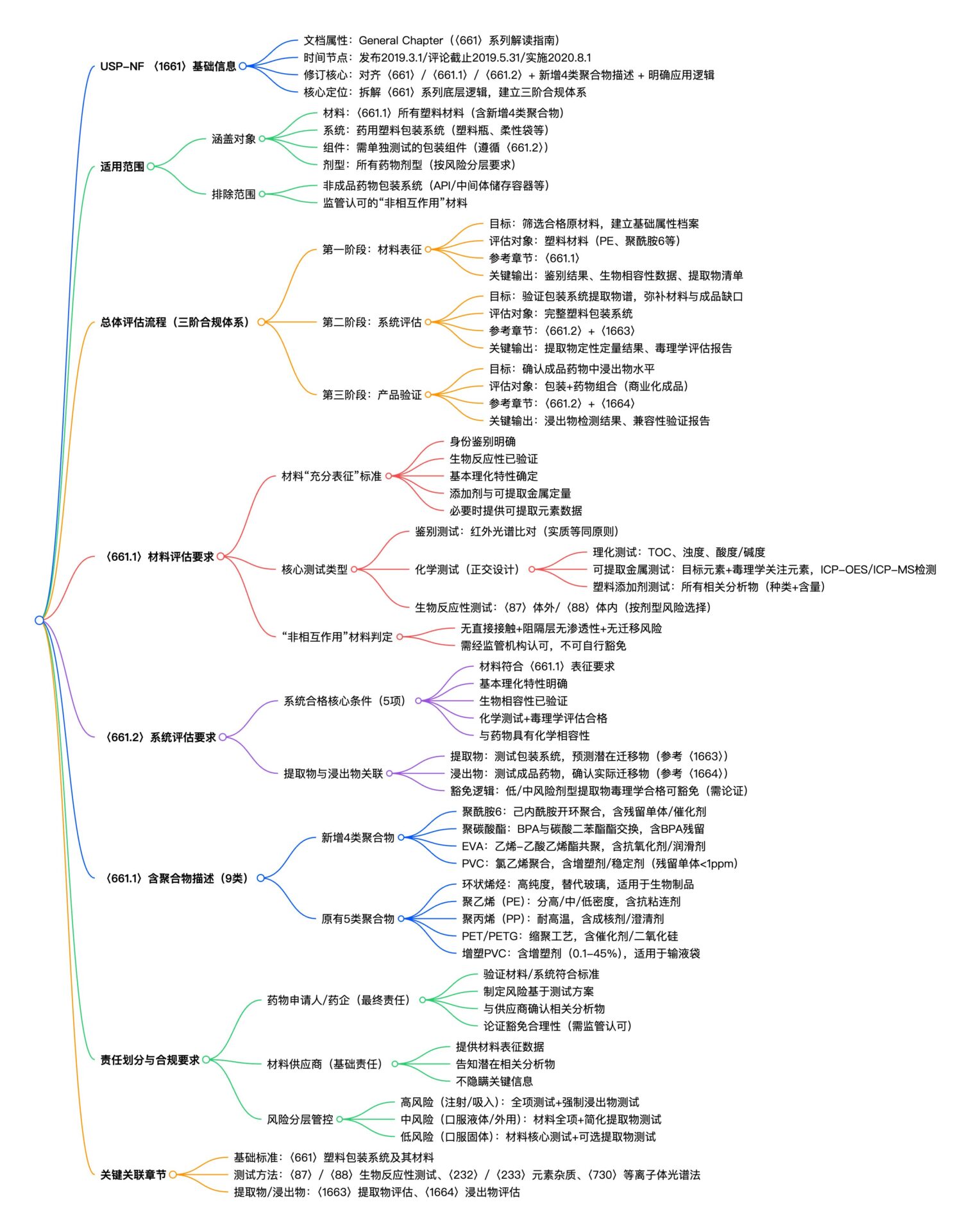
一、核心基础信息:快速了解 USP <1661>
USP <1661> 是美国药典 (USP) 中的通用章节(General Chapter),作为〈661〉系列章节(〈661.1〉/〈661.2〉)的解读与应用指南,旨在为药品的塑料包装系统的安全评估提供指导。
核心目的:
- 与〈661〉(塑料包装系统及其材料)、〈661.1〉(塑料材料)、〈661.2〉(药用塑料包装系统)修订对齐;
- 补充〈661.1〉新增的 4 类聚合物描述(聚酰胺 6、聚碳酸酯、乙烯-乙酸乙烯酯共聚物、聚氯乙烯);
- 明确〈661.1〉/〈661.2〉的适用范围、应用逻辑与包装系统评估核心要求;
核心定位:
- 拆解〈661〉系列章节的核心概念与底层逻辑,解决行业对标准应用的困惑;
- 建立“材料表征 → 系统评估 → 产品验证”的三阶合规体系;
- 明确塑料包装系统用户安全性评估的责任划分、测试要求与风险管控原则。
二、适用范围与核心框架
1. 适用范围:明确评估对象
USP <1661> 的适用范围非常广泛,涵盖了塑料包装的各个层面,但也存在一定的排除范围。
涵盖对象:
- 材料层面: 〈661.1〉规定的所有塑料材料,包括新增的 4 类聚合物(聚酰胺 6、聚碳酸酯、乙烯-乙酸乙烯酯共聚物、聚氯乙烯)。
- 系统层面: 药用塑料包装系统,如塑料瓶、预填充注射器外壳、柔性袋、吹灌封容器等。
- 组件层面: 若需单独测试包装组件(如多层膜袋的单层膜),需遵循〈661.2〉要求。
- 剂型层面: 适用于所有药物剂型,包括口服、外用、注射、吸入等,但按风险等级存在差异化要求。
排除范围:
- 非成品药物包装系统,如 API/中间体的储存容器、生产用设备系统。
- 明确判定为“非相互作用”的材料,但需经监管机构认可。
2. 核心框架:理解评估逻辑
USP <1661> 的章节按“基础认知 → 评估原则 → 分层实施 → 聚合物详解”逻辑展开,核心模块包括:
- 引言
- 范围
- 总体评估流程(三阶原则)
•〈661.1〉材料评估(表征/筛选/选择)
•〈661.2〉包装系统评估(提取物/浸出物)
•〈661.1〉/〈661.2〉适用与应用
•〈661.1〉含聚合物描述
该章节衔接 〈1663〉、〈1664〉、〈232〉、〈233〉 等核心章节。
三、核心技术内容解读:三阶合规体系与关键要素
1. 总体评估流程:三阶合规体系
〈1661〉 明确塑料包装系统的安全性评估需遵循“从材料到产品”的三阶逻辑,形成完整风险管控闭环。
| 阶段 | 核心目标 | 评估对象 | 参考章节 | 关键输出 |
|---|---|---|---|---|
| 第一阶段:材料表征 | 筛选合格的塑料原材料,建立材料基础属性档案 | 塑料材料(如聚乙烯、聚酰胺 6、PVC 等) | 〈661.1〉 | 材料鉴别结果、生物相容性数据、理化特性、提取物元素/添加剂清单 |
| 第二阶段:系统评估 | 验证包装系统的提取物谱,弥补材料与成品间的风险缺口 | 完整塑料包装系统(如塑料小瓶 + 密封垫组合) | 〈661.2〉+〈1663〉 | 包装系统提取物定性定量结果、毒理学评估报告 |
| 第三阶段:产品验证 | 确认成品药物中浸出物水平,保障用户安全 | 包装 + 药物组合(商业化成品) | 〈661.2〉+〈1664〉 | 药物中浸出物检测结果、相容性验证报告(稳定性/药效影响) |
2. 〈661.1〉 塑料材料评估:表征、筛选与选择
(1)“充分表征”的材料定义
需满足以下要求,方可视为“适用于药用包装的塑料材料”:
- 身份鉴别明确(如红外光谱匹配)。
- 生物反应性(生物相容性)已验证。
- 基本理化特性已确定(如密度、熔点、透气性)。
- 添加剂与可提取金属已定量。
- 必要时需提供可提取元素数据。
(2)核心测试要求与应用逻辑
| 测试类型 | 测试目的 | 关键要求 |
|---|---|---|
| 鉴别测试 | 确认材料类别,避免错用 | 采用“实质等同”原则(如红外光谱与对照品比对),允许因加工/组成产生的合理差异(需解释) |
| 化学测试 | 全面筛查潜在提取物风险 | 正交测试设计: 1. 理化测试(如总有机碳、浊度):评估提取物总体水平; 2. 可提取金属测试:覆盖有意添加(如催化剂锌)与毒理学关注元素(如砷、镉、铅); 3. 塑料添加剂测试:明确添加剂种类与含量(添加剂是提取物/浸出物主要来源) |
| 生物反应性测试 | 验证材料无生物毒性 | 按剂型风险等级选择体外(〈87〉)或体内(〈88〉)测试 |
(3)“非相互作用”材料的判定规则
核心定义:材料与药物无直接/间接相互作用,且无提取物迁移风险。
- 关键区分:“无直接接触”≠“非相互作用” —— 若阻隔层(如内层塑料膜)具有渗透性,外层材料(如箔袋)可能通过阻隔层迁移,仍需按“潜在相互作用”材料测试。
- 示例:水性药物装于柔性塑料容器(内层 通透性),外层箔袋为“潜在相互作用”材料(需测试);标签贴于箔袋外侧(箔袋 非渗透性 + 贴标在灭菌后),为“非相互作用”材料(豁免测试)。
- 判定要求:需经监管机构认可,不可自行豁免。
(4)提取物与浸出物的核心关联逻辑
| 维度 | 提取物(Extractables) | 浸出物(Leachables) |
|---|---|---|
| 测试对象 | 塑料包装系统本身 | 包装 + 药物组合(成品) |
| 测试目的 | 预测潜在迁移物,优化浸出物测试方案 | 确认实际迁移物水平,保障用药安全 |
| 应用价值 | . 识别目标浸出物,提高检测特异性; 2. 模拟最坏场景(如加速提取),预测最大迁移量; 3. 毒理学评估通过后,可豁免低风险剂型的浸出物测试(需提供论证) | 1. 高风险剂型(注射、吸入)强制要求; 2. 验证提取物测试的相关性与安全性结论 |
| 参考标准 | 〈1663〉 | 〈 1664〉 |
4. 〈661.1〉 含聚合物详细描述
| 聚合物类型 | 合成工艺核心 | 关键杂质/添加剂 | 适用场景 |
|---|---|---|---|
| 聚酰胺 6(Polyamide 6) | 己内酰胺开环聚合(水解/催化) | 残留单体、催化剂(铜/铬氧化物)、稳定剂(金属卤化物)、增塑剂 | 柔性管路、容器 |
| 聚碳酸酯(Polycarbonates) | 双酚 A(BPA)与碳酸二苯酯酯交换(替代光气法) | 残留单体(BPA)、催化剂(三乙胺)、UV 稳定剂、抗冲击改性剂 | 透明容器、注射器 |
| 乙烯-乙酸乙烯酯共聚物(EVA) | 乙烯与乙酸乙烯酯共聚 | 抗氧化剂、润滑剂(油酸酰胺)、无机填充剂(胶体硅) | 柔性包装、输液管路 |
| 聚氯乙烯(PVC) | 氯乙烯单体自由基聚合 | 残留单体(<1ppm)、热稳定剂(锡类/钙锌盐)、增塑剂(如 DEHP)、环氧油 | 输液袋、包装膜(需控制增塑剂迁移) |
| 环状烯烃(Cyclic Olefins) | 环烯烃与乙烯/丙烯共聚(ROMP 工艺) | 残留加工助剂、抗氧化剂 | 高纯度包装(替代玻璃)、生物制品容器 |
| 聚乙烯(PE) | 乙烯聚合(高/中/低密度) | 抗氧化剂、抗粘连剂、遮光剂(二氧化钛) | 口服/外用药物瓶、吹灌封容器 |
| 聚丙烯(PP) | 丙烯聚合(含少量乙烯/丁烯共聚) | 成核剂、澄清剂、润滑剂 | 耐高温包装、注射器组件 |
| 聚对苯二甲酸乙二醇酯(PET/PETG) | 乙二醇与对苯二甲酸缩聚 | 化剂、二氧化硅(≤0.5%)、色料 | 固体药物包装 |
| 增塑 PVC(Plasticized PVC) | PVC+ 增塑剂(如 DEHP)复合 | 增塑剂(0.1-45%)、热稳定剂、抗冲击改性剂 | 输液袋、医用管路 |
5. 关键责任划分与合规要求
| 责任方 | 核心责任 | 关键动作 |
|---|---|---|
| 药物申请人/药企 | 最终责任:确保包装系统安全适配 | 1. 验证材料/系统符合〈661.1〉/〈661.2〉; 2. 制定风险基于的测试方案(高风险剂型强化提取物/浸出物测试); 3. 与供应商协作确认“相关分析物”(如添加剂、可提取金属); 4. 论证“非相互作用”材料的豁免合理性(需监管认可) |
| 材料供应商 | 基础责任:提供充分表征的材料 | 1. 提供材料鉴别、添加剂清单、可提取元素等数据; 2. 告知药企潜在相关分析物(如含锌催化剂需提示锌为目标元素); 3. 不可隐瞒关键信息(如新增添加剂) |
四、合规延伸与关联章节:构建全面的安全保障体系
1. 风险分层管控原则
| 剂型风险等级 | 核心测试要求 | 依据 |
|---|---|---|
| 高风险(注射、吸入) | 开展材料表征 + 系统提取物测试 + 成品浸出物测试 + 毒理学评估 | 直接进入人体循环/呼吸系统,提取物风险高 |
| 中风险(口服液体、外用半固体制剂) | 材料表征 + 简化提取物测试(如仅理化测试) | 非直接进入人体或人体暴露量低 |
| 低风险(口服固体) | 材料表征 + 必要时提取物筛查 | 提取物迁移风险极低 |
2. 关键关联章节汇总
- 〈661〉塑料包装系统及其材料 塑料包装核心技术要求(含〈661.1〉/〈661.2〉子章节)
- 〈87〉体外生物反应性测试/〈88〉体内生物反应性测试
- 〈232〉元素杂质 – 限度/〈233〉元素杂质 – 程序
- 〈1663〉提取物评估
- 〈1664〉浸出物评估
五、关键问题与答案
问题 1:如何判定塑料材料是否属于“非相互作用”,从而豁免〈661.1〉测试?
答:需同时满足以下 3 个条件 + 监管机构认可:
1.材料与药物无直接物理接触(存在完整阻隔层);
2.阻隔层无渗透性(如箔袋、高密度 PE 膜),且无温度/时间诱导的迁移风险(如灭菌、长期储存不会破坏阻隔效果);
3.材料使用场景无额外应力(如贴标在灭菌后,避免高温导致粘合剂迁移)。
示例:塑料小瓶(内层 PE, impermeable)+ 外层铝塑盖(无粘合剂直接接触)+ 标签贴于铝塑盖外侧(灭菌后贴标),铝塑盖与标签可判定为“非相互作用”材料,豁免〈661.1〉测试。
问题 2:提取物测试通过毒理学评估后,是否可以豁免浸出物测试?
答:仅在满足以下条件时可豁免,且需提供充分论证:
1.提取物测试条件模拟并适度放大药物实际使用场景(如温度、接触时间、溶剂类型);
2.已明确所有提取物的身份与浓度,且最大迁移量经毒理学评估确认安全(符合监管阈值);
3.适用于低/中风险剂型(如口服固体、外用制剂);高风险剂型(注射、吸入)通常不可豁免,需结合具体药物特性与监管要求判定。
参考文献
USP<1661> Evaluation of Plastic Packaging Systems for Pharmaceutical Use and Their Materials of Construction