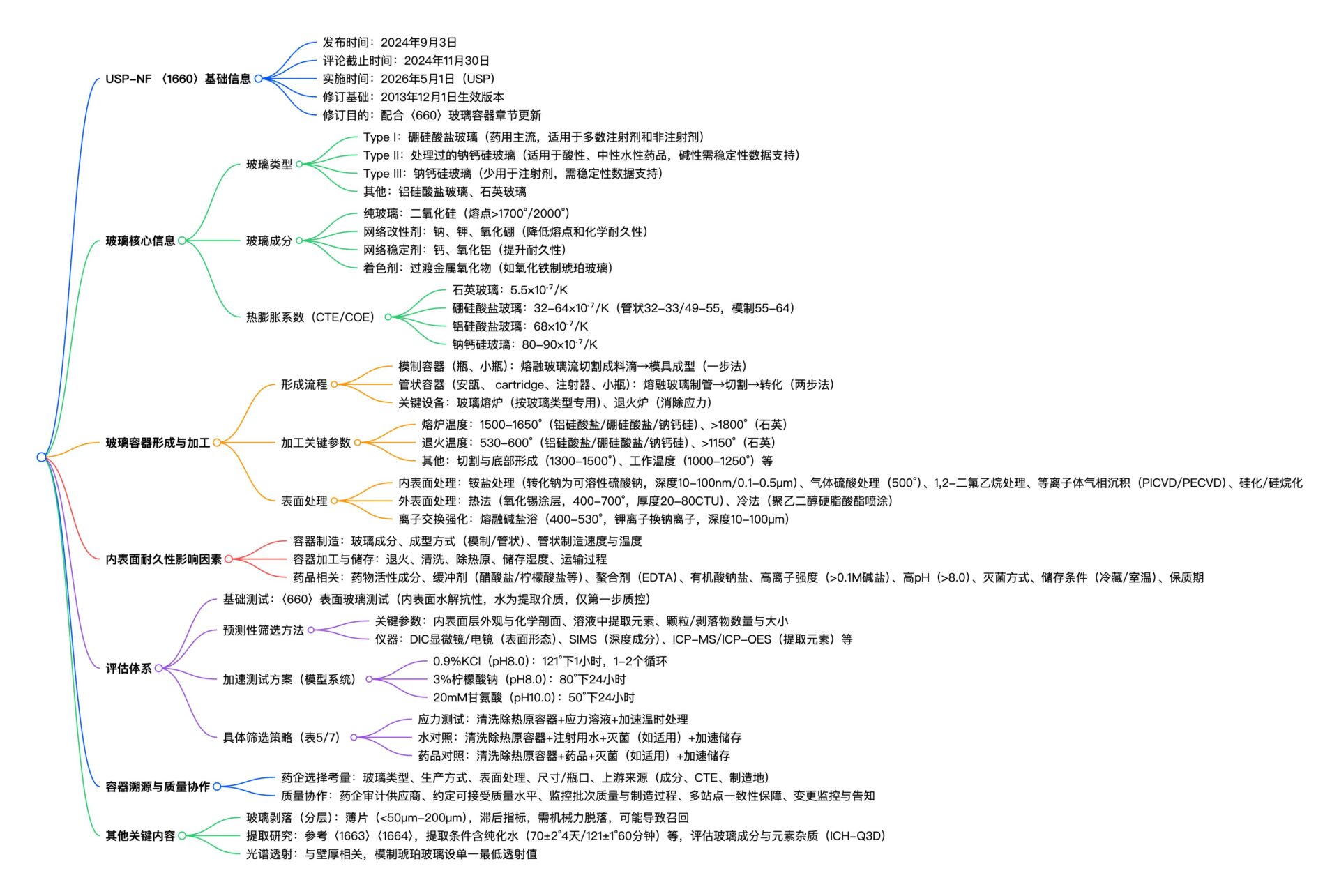
USP-NF 〈1660〉作为药用玻璃容器内表面耐久性评估的核心法规,聚焦模制 / 管形玻璃容器(安瓿、预充式注射器等)的成型、加工与测试全流程。提供了从基础筛查到加速验证的全链条评估方法,核心解决玻璃脱层、颗粒脱落等质量风险。
一、基础信息
| 维度 | 关键内容 |
|---|---|
| 文档体系定位 | 聚焦药用玻璃容器内表面耐久性评估,涵盖成型、加工、测试全流程,是〈660〉(玻璃容器通用要求)的专项补充,核心解决玻璃脱层、颗粒脱落等质量风险 |
| 核心适用边界 | – 覆盖容器:模制瓶/管瓶、安瓿、卡式瓶、预充式注射器(玻璃材质); – 玻璃类型:I类硼硅玻璃(主流)、II类处理钠钙硅玻璃、III类钠钙硅玻璃; – 管控对象:内表面化学耐久性、玻璃颗粒/薄片(脱层产物)、可提取元素、光谱透射率 |
| 核心关联依据 | 〈660〉、〈1663〉、〈1664〉、ICH Q3D、〈1228.1〉(干热除热原)、〈1229.8〉(干热灭菌) |
二、核心内容
1. 玻璃选型→加工控制→耐久性评估→风险管控
(1)前期玻璃选型与加工控制
| 步骤 | 具体操作 | 参考 |
|---|---|---|
| 1. 玻璃类型选型 | 按剂型风险分级选择: – 高风险(生物制品、注射剂):I类硼硅玻璃(低膨胀系数32–33或48–56); – 中风险(口服制剂):II类处理钠钙硅玻璃; – 低风险(外用制剂):III类钠钙硅玻璃 |
参考〈660〉确定玻璃选型 |
| 2. 供应商资质审核 | – 玻璃配方、热膨胀系数; – 成型工艺参数(加热温度、退火条件); – 表面处理记录(如硫酸铵脱碱、等离子沉积涂层); – 批次间质量一致性报告 |
建立《玻璃容器供应商资质档案》 |
| 3. 加工过程控制 | 关键参数管控: – 成型温度:避免超过1500℃(防止碱硼酸盐挥发); – 退火工艺:按玻璃类型设定温度(硼硅玻璃550–600℃); – 后处理:硫酸铵处理后需彻底清洗(残留钠硫酸盐≤0.1μg/cm²) |
加工关键参数与验证数据 |
(2)内表面耐久性核心评估流程
| 评估阶段 | 具体操作 | 通用标准 | 生物制品关注 |
|---|---|---|---|
| 基础筛查) | 执行〈660〉表面玻璃测试: – 样品制备:容器内注入纯化水,121℃高压灭菌1小时; – 检测指标:滴定法测浸出碱度(硼硅玻璃≤0.10 mL 0.02N HCl/100mL) |
碱度结果需稳定,控制批次间差异 | 额外检测浸出硅含量,避免硅对蛋白聚集影响 |
| 深度筛查 | 1. 外观检查:显微镜观察内表面(无麻点、坑洼现象); 2. 元素分析:ICP-MS检测可提取元素; 3. 表面形态:SEM观察内表面微观结构(无裂纹) |
可提取元素需符合ICH Q3D PDE限值,无可见颗粒 | 蛋白相容性测试:玻璃浸出液与生物制品孵育后,SEC法测蛋白聚集率 |
| 加速老化验证(稳定性支持) | 采用加速体系: – 体系1:0.9% KCl(pH8.0),121℃灭菌1–2个循环; – 体系2:3%柠檬酸钠(pH8.0),80℃放置24小时; – 体系3:20mM甘氨酸(pH10.0),50℃放置24小时 |
加速后无脱层 | 采用生物制品或安慰剂作为加速介质,监测玻璃脱片 |
(3)生物制品包装专项要求
| 控制维度 | 实操动作 | 验证标准 |
|---|---|---|
| 玻璃表面改性 | 优先选择等离子沉积(PECVD)涂层玻璃: – 涂层类型:SiO₂或类金刚石涂层; – 涂层验证:附着力测试(胶带剥离后无脱落)、蛋白吸附测试 |
涂层后玻璃浸出元素降低,蛋白聚集率下降 |
| 除热原与灭菌控制 | 1. 除热原:250–350℃干热处理,避免水汽存在; 2. 灭菌:110–130℃高压灭菌,灭菌后立即干燥(残留水分≤0.1%) |
除热原后内毒素≤0.25 EU/mL,灭菌后无内表面裂纹 |
| 容器处理与储存 | 1. 除热原后静置≥24小时(形成保护膜); 2. 采用“巢式包装”(nests/tubs)运输,避免玻璃间摩擦; 3. 储存环境:湿度40%–60%,避免温度剧烈波动 |
运输后玻璃外表面划痕率下降,内表面无新增颗粒 |
| 可提取元素管控 | 重点监测3类元素: – 致敏元素:Ni、Co(CTCL≤35μg/g); – 蛋白相互作用元素:Al、Fe(≤1μg/mL); – 重金属:Cd、Pb(符合ICH Q3D PDE) |
可提取元素总量≤10μg/mL,无单一元素超标 |
2. 关键风险点与管控措施
(1)通用高风险点管控
| 风险点 | 成因 | 措施 |
|---|---|---|
| 玻璃脱层 | 内表面碱耗尽层+ 侵蚀性制剂(高pH、螯合剂) | 1. 避免选用硫酸铵处理玻璃; 2. 制剂pH控制,如4.0–7.0; 3. 螯合剂(如EDTA)浓度控制,例如≤0.01M |
| 颗粒脱落 | 加工过程划痕、运输摩擦、破裂 | 1. 成型后彻底清洗; 2. 运输采用缓冲材料分隔; 3. 灭菌后避免剧烈震荡 |
| 化学腐蚀 | 制剂含枸橼酸、 葡萄糖酸等有机酸盐 | 1. 优先选用低膨胀系数硼硅玻璃; 2. 加速验证中加入对应盐类体系; 3. 控制制剂离子强度 |
(2)生物制品特有风险管控
| 特有风险 | 成因 | 实操管控措施 |
|---|---|---|
| 蛋白聚集 | 玻璃浸出金属离子(如Al³⁺)催化氧化 | 1. 选用低金属含量玻璃(Al≤0.5%); 2. 制剂中加入金属螯合剂; 3. 玻璃浸出液与蛋白孵育验证 |
| 蛋白吸附 | 玻璃内表面羟基与蛋白相互作用 | 1. 采用硅烷化处理玻璃; 2. 制剂中加入表面活性剂(如Polysorbate 80); 3. 吸附测试 |
三、关键问题
问题1:生物制品用玻璃容器经除热原后,内表面易出现划痕,如何规避?
解决方案:
- 除热原工艺优化:采用梯度升温(50℃→200℃→300℃),避免热冲击导致表面脆化;
- 处理后防护:除热原后立即转入“巢式包装”,避免人工接触内表面;
- 质量筛选:除热原后增加外观检查(立体显微镜),不合格品剔除。
问题2:高pH生物制品(pH8.5)选用I类硼硅玻璃,加速测试中出现脱层迹象,如何处理?
解决方案:
- 表面改性:更换为SiO₂涂层I类硼硅玻璃,重新进行加速验证;
- 制剂调整:加入0.005M硼酸盐缓冲液(抑制硅烷醇水解),维持pH稳定;
- 玻璃选型:更换低膨胀系数(32–33)硼硅玻璃,降低热加工导致的表面不均;
- 替代方案:若上述措施无效,更改包材的材质,例如改用COC预充式注射器。
四、常见误区
| 误区 | 后果 | 纠正动作 |
|---|---|---|
| 用纯化水替代药品进行加速验证 | 无法模拟实际制剂对玻璃的腐蚀,导致风险漏判 | 加速验证需用制剂安慰剂或实际制剂,确保相关性 |
| 忽视玻璃除热原后的静置步骤 | 表面无保护膜,易产生划痕和腐蚀 | 除热原后静置≥24小时,形成羟基保护膜 |
| 认为涂层玻璃无需测试 | 涂层可能脱落,导致后期风险 | 涂层玻璃仍需进行验证,测试涂层稳定性 |