制药行业共同的“顽疾”
在生物制药领域,聚山梨酯20(PS20)和聚山梨酯80(PS80)是保护蛋白质药物免受界面应力损伤的“常用表面活性剂。
然而,一个困扰行业多年的问题始终如影随形:聚山梨酯的降解及其导致的可见微粒形成?
过去,我们的认知大多停留在“降解产物(游离脂肪酸,FFA)累积,一旦超过溶解度上限便会析出微粒”这一物理规律上。但在实际的研发和稳定性考察中,许多人发现了一个诡异的现象:即使游离脂肪酸的浓度远低于其理论溶解度,可见微粒依然会不期而至。
这种不可预测性给研发节奏带来了巨大挑战,也让生产端和销售端面临产品退货、灯检不合格率升高以及终端用药安全的风险。2020年,由罗氏(Roche)研发团队发表的研究,揭开了玻璃药包材中的浸出物(Leachables),如何通过“成核效应”诱发脂肪酸微粒。
本文将深度拆解这一研究,为医药行业的各环从业者提供策略建议。
聚山梨酯降解与游离脂肪酸(FFA)
在深入探讨玻璃的作用之前,我们先了解基础背景。
1. 降解的路径
聚山梨酯降解主要有两条路:氧化降解和水解降解。
近年来,酶促水解(由宿主细胞蛋白HCP残留,如脂肪酶引发)被证实是导致生物制品中PS20/PS80损失的主要原因。水解的直接后果是释放下游游离脂肪酸(FFA),如月桂酸(Lauric acid, C12)、肉豆蔻酸(Myristic acid, C14)和棕榈酸(Palmitic acid, C16)。
2. 溶解度困境
游离脂肪酸极度疏水。在典型的单抗制剂(pH 5.5 – 6.0)中,这些脂肪酸的溶解度极低。当浓度突破阈值,它们会聚集形成可见或亚可见微粒。
然而,研究发现,在实际产品中,观察到的微粒形成时间点与脂肪酸的浓度、pH值、温度等常规变量并不完全匹配。
这意味着,体系中存在某种“成核因子”,降低了脂肪酸析出的能量势垒。
玻璃浸出物是“成核种子”吗?
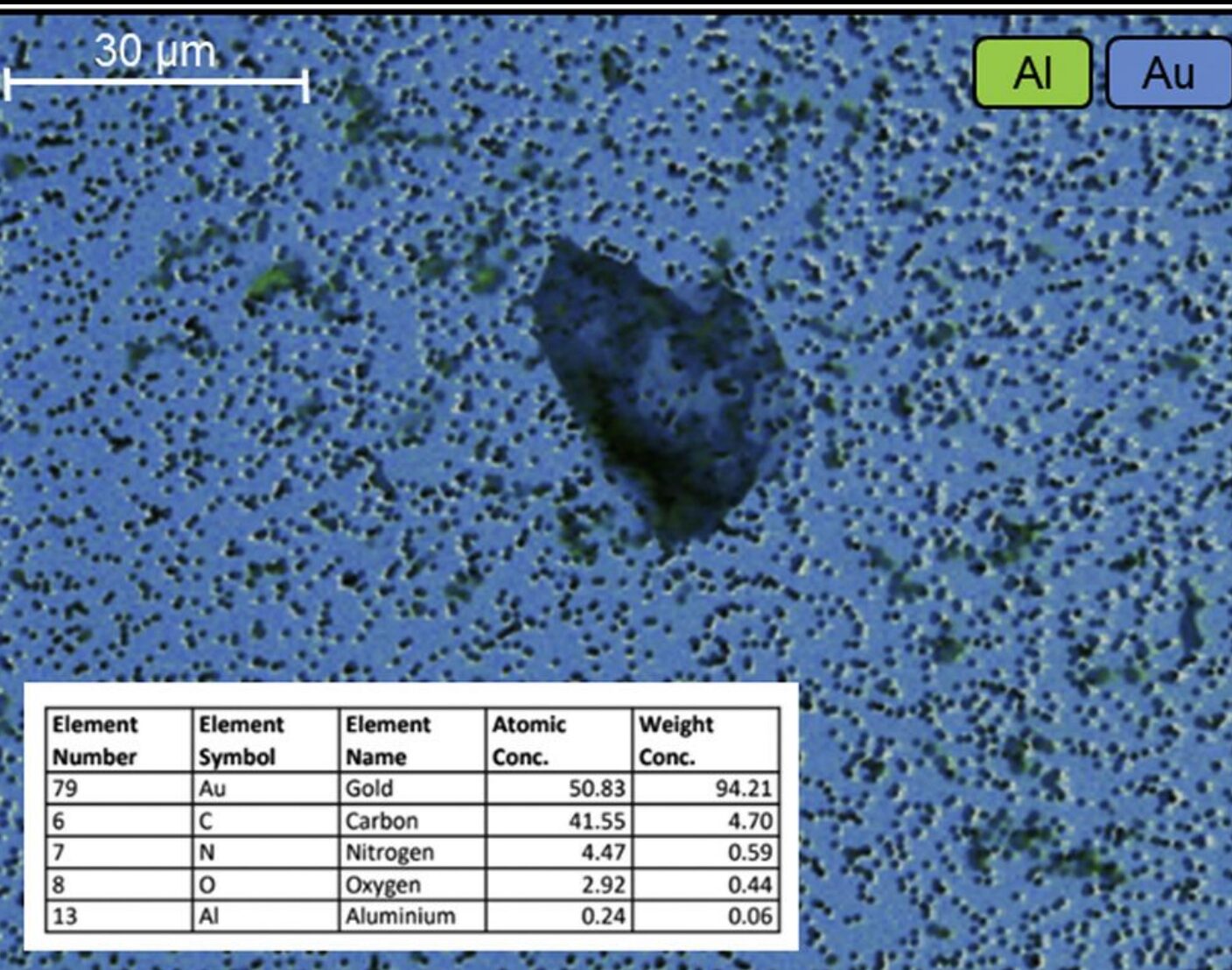
研究发现,在一些受损产品微粒的SEM-EDX(扫描电镜-能量耗散X射线分析)图谱中,除了碳和氧(代表脂肪酸),还检测到了铝(Al)、硅(Si)、钠(Na)、钙(Ca)等元素。
这组元素具有明显的指向性——它们正是硼硅玻璃药瓶的主要成分。
硼硅玻璃由网络形成体(SiO2, B2O3, Al2O3)和网络改性体(Na2O, CaO等)组成。在灭菌、清洗及长期储存过程中,这些无机离子会缓慢释放到制剂液中。
玻璃中浸出的无机元素可以作为“成核种子”,在游离脂肪酸浓度尚未达到其理论溶解度上限时,诱导其析出并形成复合物微粒。
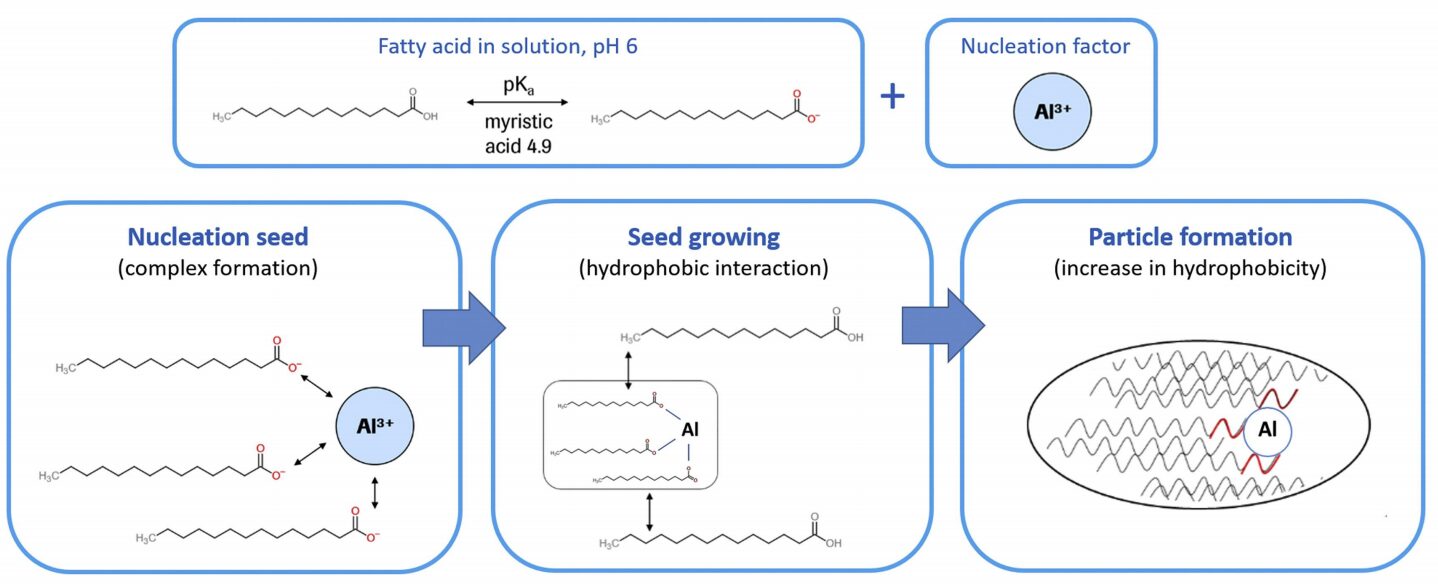
机制解析——为何金属离子能诱发微粒?
在典型的制剂环境(如pH 5.5-6.0)中,游离脂肪酸处于质子化与非质子化的动态平衡中。研究提出,当金属离子(如三价铝离子 Al³⁺)存在时,它会与脂肪酸根结合形成高度难溶的复合物:
- 成核(Nucleation): 1个Al³⁺离子可与3个去质子化的脂肪酸分子结合,形成极性极低的“种子”。
- 疏水聚集: 这种种子具有极强的疏水表面,诱导溶液中原本增溶在胶束中或溶解态的脂肪酸分子迅速向其聚集,产生“滚雪球”效应,最终跨越亚可见微粒(SVP)阶段,演变为可见微粒。
模拟实验与真实玻璃浸出物
为了验证玻璃中浸出的无机元素可以作为“成核种子”的假设,设计了一系列实验。
1. 模拟盐实验
选取了CaCl2、NaAlO2、NaBO2等无机盐,模拟玻璃浸出的典型离子。
-
结果显示: 加入肉豆蔻酸(C14)或月桂酸(C12)后,即使脂肪酸浓度控制在溶解度以下,在CaCl2和NaAlO2存在的情况下,溶液迅速产生了可见微粒。
-
铝离子(Al³⁺)的独特性: 铝离子的诱导效应极其显著。即使铝浓度低至ppb级别(10-50 ng/mL),也能在短短1周内诱发明显的脂肪酸析出。这与商业化产品中检测到的铝浸出水平高度吻合。
-
对比: 钙离子(Ca²⁺)虽然也能诱发微粒,但所需的浓度显著高于铝离子。这意味着铝离子是玻璃浸出物中风险最高的“头号成核剂”。
2. 浓度与动力的关联
研究发现,微粒的形成具有明显的时间依赖性。随着孵育时间延长,微粒数量显著增加。这意味着,玻璃浸出物并非仅仅导致化学沉淀,而是触发了一个持续的成核与晶体生长过程。
3. “真实”玻璃浸出物实验
模拟盐虽然能说明问题,但真实的浸出物是复杂的混合物。研究人员对两类市售硼硅玻璃瓶(Vial Type 1 和 Type 2)进行了三次高压灭菌处理,以产生“真实”的浸出液。
- 发现: 不同的玻璃瓶工艺产生的浸出物成分比例不同。铝离子含量较高的瓶子,诱发脂肪酸微粒的速度和数量明显高于铝含量较低的瓶子。
- SEM-EDX确认: 在析出的微粒表面,检测到了硅、铝、钙、镁等元素的复合存在。这有力地证明了微粒并非单纯的脂肪酸堆积,而是脂肪酸与金属离子的复合物。
颗粒的扫描电子显微镜 – 能量色散 X 射线光谱(SEM-EDX)分析
案例研究—— 老化的mAb 制剂
对两款真实的制剂(5°C 存放22个月)的案例分析。mAb1 和 mAb2 使用了相同的处方,且聚山梨酯20(PS20)的降解速率几乎一。
1. 不同的降解特征
尽管 PS20 总量下降幅度相似,但由于宿主细胞蛋白(HCP)残留种类的微小差异,两者释放出的 FFA 组分完全不同:
- mAb1: 主要释放 月桂酸(C12)。浓度约为 22 μg/mL,而肉豆蔻酸(C14)仅为 2 μg/mL。
– mAb2: 释放了大量的 肉豆蔻酸(C14)。浓度高达 15 μg/mL,而月桂酸(C12)约为 10 μg/mL。
2. C14 浓度与微粒形成的强关联性
为什么 mAb2 释放更多的 C14 会导致微粒形成的风险剧增?这涉及到不同同系物的溶解度差异:
-
溶解度对比: 在 pH 5.5 的组氨酸缓冲液中,月桂酸(C12) 的理论溶解度约为 15 μg/mL,而 肉豆蔻酸(C14) 的理论溶解度仅为约 7.5 μg/mL。
-
结果关联:
mAb2 中的 C14 浓度(15 μg/mL)已经两倍于其理论溶解度,因此即使没有成核因子,它也处于析出的边缘。在25°C 储存12个月后,只有 mAb2 出现了可见微粒。这证明了 C14(肉豆蔻酸)是诱发脂肪酸微粒的关键罪魁祸首。长链脂肪酸由于疏水性更强、溶解度更低,对金属离子的“成核感应”远比短链的 C12 敏感。
3. 浸出物的“致命一击”
当向这些原本看似稳定的制剂中加入微量的玻璃浸出液后,原本澄清的液体迅速出现了可见微粒。
- 添加量: 将 5 mL 的单抗制剂中分别加入 50 μL 或 500 μL 的玻璃浸出液(稀释比为 1:100 或 1:10)。
- 实验发现: 这种微量的“掺杂”迅速诱发了原本澄清的 mAb1 也产生了可见微粒。通过 SEM-EDX 鉴定,微粒表面精准锁定了铝、硅、钙等金属元素。
肉豆蔻酸与铝的游离脂肪酸(FFA)颗粒形成机制(依赖成核因子)示意图
成核效应核心机制解析
基于上述发现,研究提出了一种游离脂肪酸-金属离子复合物成核模型(Nucleation Theory):
-
离子交换与释放: 玻璃表面的离子因环境影响(如高pH、特定缓冲盐)释放。
-
络合反应: 以三价铝离子(Al³⁺)为例,它能与三个去质子化的脂肪酸分子结合,形成极难溶的“脂肪酸铝盐(Aluminum-fatty acid-tri-carboxylates)”。
-
微观成核: 这种铝盐作为“成核种子”,具有极强的疏水性表面。
-
定向聚集: 溶液中剩余的游离脂肪酸分子通过疏水相互作用,迅速聚集在这些种子的表面。
-
宏观显现: 随着聚集体增大,跨越了亚可见微粒(Sub-visible)的阶段,最终变成肉眼可见的白色薄片状或点状微粒。
医药行业各环节的启示与策略
1. 研发人员(R&D):精细化监控降解组分
不仅仅看 PS20 剩余量: 必须定量监测 FFA 的同系物分布。如果制剂中释放的 肉豆蔻酸(C14)或棕榈酸(C16) 比例较高,即使 PS20 总降解量不多,微粒风险依然是“红色等级”。
重新定义溶解度安全线: 在存在玻璃浸出物的情况下,FFA 的溶解度会显著降低。研发阶段的压力测试应加入“金属离子挑战实验”。
2. 生产与包装人员:全流程防控
这部分是受浸出物影响最直接的环节,需从以下三个维度细化:
- 药瓶供应商的严格筛选(重点关注铝释放): 不同玻璃管拉制工艺(如成型过程中的碱金属蒸发与再沉积)会导致铝浸出量跨越两个数量级。
生产采购应要求供应商提供不同pH条件下的铝离子浸出动态数据,优先选择低铝(Low-Al)瓶型。
-
控制清洗与灭菌强度的“平衡”: 清洗时的去离子水纯度、洗瓶机喷嘴的磨损、以及灭菌锅的循环次数均会影响玻璃表面的完整性。实验证明,过多的灭菌循环会显著增加玻璃表面的化学易感性,加速铝和硅的释放。对于聚山梨酯敏感药物,应尽可能缩短高温处理时间。
-
生产线的金属污染防控: 除了包材,生产管路中的不锈钢磨损、不合格的过滤器支架、甚至缓冲盐辅料中的微量金属杂质,都可能成为“成核种子”。在 PS20 易降解的产品线中,应建立关键工艺点(CPP)的金属离子监测。
3. 销售与技术支持
当客户反馈微粒时,不再只能解释为“蛋白聚集”。通过 SEM-EDX 分析微粒中是否存在铝、硅元素,可以快速锁定是包装材料适配性问题还是降解超标,从而提供更具说服力的技术支持。
结语
我们不能孤立地看待降解,而必须将其置于整个容器闭合系统中观察。
随着生物药市场的竞争加剧,对产品一致性和纯净度的追求已近苛刻。理解并掌握“浸出物诱发成核”的机制,将帮助我们更早地在研发阶段规避风险,减少生产中的误剔率,并最终确保患者手中的每一支注射剂都是安全、纯净的。
参考文献:
Allmendinger A, et al. Glass leachables as a nucleation factor for free fatty acid particle formation in biopharmaceutical formulations. J Pharm Sci. 2020;109(11):3275-3287.