从传统的“重金属检测”到现代的“元素杂质管控”
随着 ICH Q3D 指南的颁布和全球药典的跟进,制药行业进入了基于风险管理(Risk-based approach)的元素杂质(Elemental Impurities, EIs)管控时代。本文将结合该文献的核心数据与前沿观点,深度拆解元素杂质的毒理逻辑、污染路径、法规框架及尖端分析技术。
第一章:元素毒理学的进阶认知——生物可及性与生物利用度
元素在药品中的含量(Total Content)并不直接等同于其对人体的安全风险。
评估元素杂质的真实威胁,必须引入两个关键的毒理学参数:生物可及性(Bioaccessibility)和生物利用度(Bioavailability)。
1.1 生物可及性(Bioaccessibility)
生物可及性是指元素从制剂基质(Matrix)中释放出来,并溶解在胃肠道液中,从而能够被吸收的最大潜在量。
- 物理屏障效应:在固体口服制剂中,由于聚合物包衣或缓释基质的存在,某些金属离子可能在通过消化道时并未完全释放。
- 体外研究模型:通过模拟胃肠道环境的体外提取试验,可以评估元素的生物可及性。例如,在一项针对阿育吠陀(Ayurvedic)传统药物的研究中,虽然砷、铬、汞的总含量极高,但其生物可及性部分才是评估其导致慢性中毒的关键。
1.2 生物利用度(Bioavailability)
生物利用度是指元素进入体循环(血液)的速度与程度。
- 化学形态的影响:这是生物利用度的决定性因素。以汞(Hg)为例,金属汞蒸气主要通过呼吸道吸收,而甲基汞在肠道中的吸收率接近100%。在药品中,如果元素以难溶的无机盐形式存在,其生物利用度极低;但若与某些赋形剂形成络合物,其极性改变可能显著增加其穿过生物膜的能力。
- 剂量依赖与累积:通过对斑马鱼暴露于氯化汞(II)的研究证明,汞在内脏和鳃中的累积呈现明显的剂量依赖性。更重要的是,必需微量元素(如 Fe, Cu, Zn)的浓度在汞暴露下并未发生变化,说明某些重金属的生物累积具有高度的特异性和毒性针对性。
风险评估报告不应仅停留于“符合限度”,还应考虑给药途径。例如,注射剂(Parenteral)绕过了胃肠道屏障,其生物利用度视为100%,因此其 PDE 值通常比口服制剂严苛 10 倍以上。
第二章:污染路径的拆解——从源头到成品的链条
元素杂质进入药品的四条主路径:
2.1 活性药用成分(API)与催化剂残留
API 合成过程中使用的金属催化剂是最明确的风险源。
- 铂族元素(PGEs):如 Pd, Pt, Rh, Ru。它们广泛用于 C-C 偶联反应。
- 设备浸出:不锈钢反应釜在强酸或高温条件下可能释放 Cr, Ni, Mo。文献警示,实验室玻璃仪器也并非绝对惰性,某些劣质玻璃器皿在碱性条件下会贡献 ppb 级别的 Cu 和 Fe。这些微量金属即便不超标,也可能催化 API 发生氧化降解,缩短药品的货架期。
2.2 辅料:被忽视的“重灾区”
研究对 190 个辅料样本(涵盖 31 种类型)进行了 ICP-MS 检测。 典型数据:
- 二氧化钛($TiO_2$):铅(Pb)的平均含量高达 $2.15 \pm 1.81 \mu g/mL$。
- 矿物来源赋形剂:如硬脂酸镁、滑石粉、碳酸钙。研究发现,部分滑石粉样本中的铅和镉(Cd)超标严重,这主要归因于矿床的天然污染。
- 合成来源 vs 天然来源:纤维素类辅料表现出极低的杂质水平(接近检测限),而矿物提取物则呈现高变异性。
2.3 天然产物与植物药的富集风险
天然产物在元素杂质管控上面临巨大挑战,因为植物具有强大的环境富集能力。
- 土壤与农药残留:铅、砷、镉主要来源于受污染的土壤和磷肥的使用。
- 卡托姆(Kratom)案例:文献提到在美国 Richmond 购买的 27 种 Kratom 产品中,虽然绝大多数元素受控,但锰(Mn)的含量惊人,部分样本每日摄入量超标 5-20 倍,长期服用可能导致锰中毒(Manganism),表现为类似帕金森的神经退行性症状。
- 大麻产品(Cannabis):南非市场的一项研究显示,15% 的样本未能通过 USP/ICH 的口服限度,主要超标元素为 Hg, Ni, Pb。
2.4 包装材料与浸出物
容器密封系统(CCS)是药品生命周期的最后一道环节。
- 塑料与弹性体:催化剂残留(如 Sb 锑)或添加剂(如 Ba 钡)可能迁移至液体药剂中。
- 给药器械:吸入剂和注射剂的金属部件是 Ni 和 Cr 的潜在来源。
第三章:全球法规框架的纵览
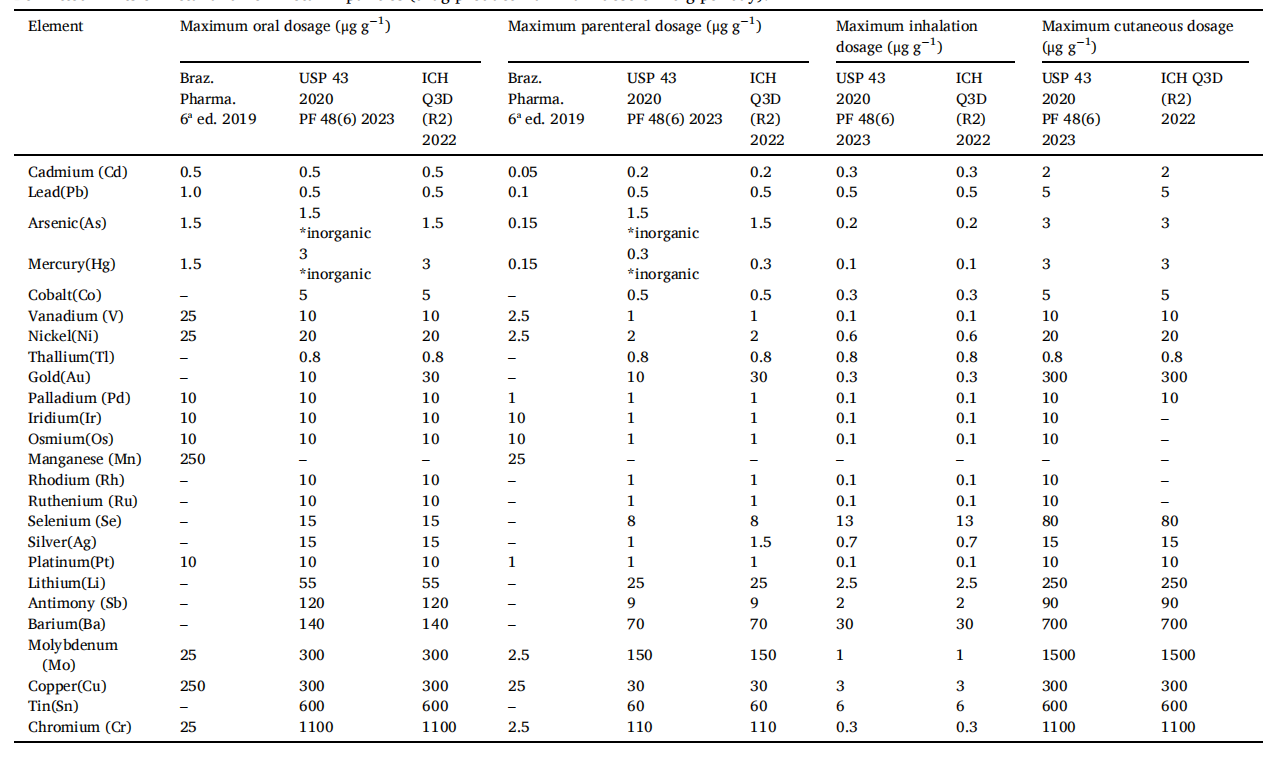
3.1 ICH Q3D 指南:全球共识
ICH Q3D 将元素分为四大类,这种分类基于毒性(PDE)和发生概率:
- 1 类(As, Cd, Hg, Pb):由于高毒性,在所有给药途径中均需评估。
- 2A 类(Co, Ni, V):在药品中发生的概率较高,必须评估。
- 2B 类(如 Pd, Pt, Rh等):除非在生产中故意添加,否则通常不评估。
- 3 类(如 Sb, Ba, Cu, Sn等):口服制剂风险极低,仅在吸入或注射给药时重点关注。
3.2 USP <232> & <233>:实操的标准
USP 不仅设定了限度,还通过 <233> 规定了验证标准。
- Option 1 评估逻辑:假设每日服用 10g 药品。如果所有组分(API+赋形剂)的元素浓度均低于限度,则成品合格。
- 皮肤给药的特殊性:文献提到最新的法规动态(如 USP PF 48(6)),针对镍(Ni)和钴(Co)设定了皮肤和透皮浓度限度(CTCL),以防止对过敏体质人群造成皮肤损伤。
3.3 各国药典的差异(以巴西为例)
巴西药典(Brazilian Pharmacopeia)在某些方面比 ICH 更为严格或具有特色:
- 锰(Mn)的管控:巴西药典明确规定了口服最大剂量下的 Mn 限度为 250 ug/g,而 ICH Q3D 核心指南中并未将其列为强制评估元素。
- 缺失部分:巴西药典目前对吸入和皮肤途径的限度规定尚不完整,企业在申报时通常需参考 USP 或 EMA 指南。
第四章:技术核心——电感耦合等离子体(ICP)技术深度解析
虽然 AAS 依然有效,但 ICP 技术(ICP-OES 和 ICP-MS)已成为不可替代的金标准。
4.1 ICP 技术的物理基础
ICP 的核心是一个由高频感应电流产生的等离子体焰炬,其温度高达 6000K 至 10000K。
- 高效激发:在这种极端温度下,几乎所有的化学键都会断裂,样本被完全原子化和离子化,从而消除了大部分基质干扰。
4.2 ICP-OES(光学发射光谱法)
- 原理:测量受激原子返回基态时发射的特征光谱。
- 优势:耐用性强,适合分析高含量的元素(如常量元素 Ca, Mg),抗盐分干扰能力好。
- 提升策略:文献提到,通过耦合轴向观测(Axial View)和超声雾化器(Ultrasonic Nebulizer, USN),ICP-OES 的检出限可以显著提升,满足部分口服制剂的合规要求。
4.3 ICP-MS(质谱法)
- 原理:根据荷质比(m/z)对离子进行分离和计数。
- 核心优势:
- 灵敏度:可达到 ppt(万亿分之一)级别,对于注射剂中极低的 Pb, Hg 限度至关重要。
- 动态范围:跨越 9 个数量级,允许在一个方法中同时检测痕量 Pb 和常量元素。
- 干扰管理:这是质谱技术的难点。
- 多原子干扰:例如,药液中的氯离子(Cl)会与等离子体中的氩(Ar)形成 ArCl,干扰砷(As)的检测。推荐使用碰撞/反应池技术(KED/DRC),通过通入氦气(He)或氢气(He),利用动能区分效应消除这些干扰。
第五章:形态分析(Speciation)——风险评估的新前沿
元素的总含量只能反映污染程度,只有形态分析才能反映真实毒性。
5.1 为什么需要形态分析?
- 铬(Chromium):Cr(III) 是人体必需的葡萄糖耐量因子,基本无毒;而 Cr(VI) 是强致癌物,能穿透细胞膜造成 DNA 损伤。
- 砷(Arsenic):无机砷(AsIII, AsV)毒性剧烈,而有机砷(如阿散酸)毒性极低。
- 汞(Mercury):在膳食补充剂(如鱼油)中,必须区分甲基汞与无机汞。
5.2 联用技术(Hyphenated Techniques)
形态分析的核心是将分离技术与高灵敏度检测器耦合:
- HPLC-ICP-MS:目前应用最广。离子交换色谱或反相色谱将不同价态、不同络合形式的金属分离,随后依次进入 ICP-MS 进行元素特异性检测。
- 挑战:由于药品生产过程中可能发生形态转化(例如,氧化性赋形剂将 Cr(III) 氧化为 Cr(VI)),文献建议在工艺验证(PV)阶段加入形态分析,以确保在整个货架期内药品的安全性。
参考文献
- Augusto Cezar et al. Analytical approach of elemental impurities in pharmaceutical products: A worldwide review, Spectrochimica Acta Part B: Atomic Spectroscopy (205) 2023.