文末可以下载原文FDA《Small Volume Parenteral Drug Products and Pharmacy Bulk Packages for Parenteral Nutrition: Aluminum Content and Labeling Recommendations Guidance for Industry》,和中文翻译《小容量注射剂药品和药房批量包装,用于肠外营养:铝含量和标签建议》。
一、 铝中毒的潜在危害与指南出台背景
肠外营养作为重要的营养支持手段,其安全性至关重要。铝作为长期使用肠外营养(PN)药物潜在的污染物,长期蓄积可导致严重的健康问题,如骨病和神经系统毒性,对肾功能不全患者和新生儿的风险尤为突出。
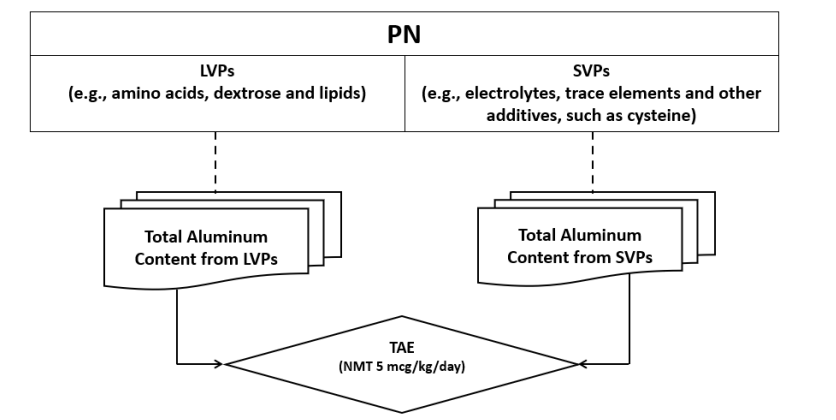
临床常见的PN制品:
- 肠外营养剂:葡萄糖,脂肪乳剂,氨基酸,电解质,维生素,微量元素
- 全营养混合液:从制剂角度,将葡萄糖、氨基酸和脂肪乳混合在一起,加入其他各种营养素后放置于一个袋子中输注
- 复方氨基酸注射液
二、 指南核心内容
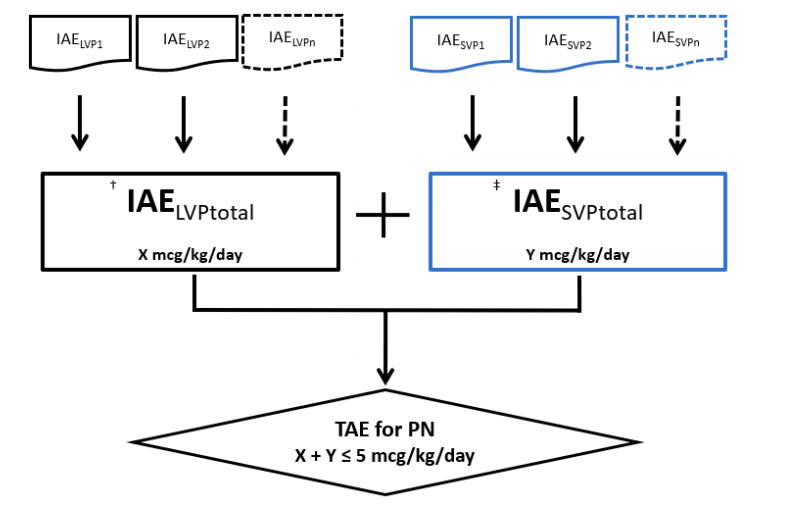
总铝暴露量(TAE)的限制: FDA建议,来自长期使用肠外营养(PN)所有组分(包括大容量注射剂LVP和小容量注射剂SVP)的总铝暴露量不应超过4-5 ug/千克/天。这一阈值是评估PN方案安全性的重要参考。
小容量注射剂(SVP)的铝浓度限值(ACL)推导: 尽管法规已对LVP的铝含量(≤25 ug/L)做出限制,但SVP尚无明确规定。指南重点阐述了SVP的ACL推导方法,核心在于确保每个SVP的个体铝暴露量(IAE)在合理范围内,建议不超过 0.6 ug/kg/天,以避免多种SVP联合使用时导致TAE超标。
生产质量控制的关键要素: 指南强调,制药企业应将铝污染控制纳入全面的质量管理体系,从原材料、生产工艺、设备选择到包装材料,均需进行风险评估和有效控制,并使用经验证的分析方法进行铝含量测定。企业应基于产品特性和患者需求,设定合理的铝含量验收标准。
标签信息的强制性要求: 为提升临床用药的安全性,指南对PN药物的标签提出了详细要求:
处方信息: 需在警告和注意事项部分明确铝中毒风险,对于LVP注明铝含量上限。同时,应在描述部分标明产品的实际铝含量。对于有特定风险人群(如新生儿),需在特定人群使用部分进行警示,甚至在适应症和用法部分考虑使用限制。
容器和纸箱标签: 必须清晰标注产品在有效期内可能达到的最大铝含量,对于SVP,若最大含量不超过25 ug/L,可简化标注。
三、 对行业实践的启示
本指南草案的发布,对制药行业提出了更高的要求:
- 加强风险评估: 企业需对现有及在研的PN产品进行全面的铝污染风险评估。
- 优化生产工艺: 改进生产流程,选择低铝污染风险的设备和包材。
- 完善质量标准: 根据指南建议,设定科学合理的铝含量质量标准。
- 更新标签信息: 确保产品标签清晰、准确地传递铝中毒风险信息。