ICH Q3E 的发布弥补了药品法规领域二十余年的空白,旨在解决E&L评估在全球制药公司中面临的挑战,其根本原因在于各个地区和剂型之间法规要求的碎片化。
ICH Q3E整合了源自ICH Q9的风险管理原则,贯穿于危害识别、风险评估、风险控制和生命周期管理,降低在早期开发阶段进行药品安全评估的难度。
与以往的指导文件相比,ICH Q3E提供了更全面的框架,有助于简化流程、降低成本并确保患者获得药物的可及性。
自 FDA 1999 年的《容器封闭系统指南》和 EMA 2005 年的《塑料直接包装材料指南》发布以来,可提取物和浸出物 (E&L) 的监管环境在不同地区和剂型之间依然存在碎片化现象。这种不统一给全球制药企业带来了诸多挑战,包括方法学上的不一致、对法规要求的不同解读以及显著的监管不确定性,最终影响了患者获得药物的可及性。
全面的风险管理框架整合
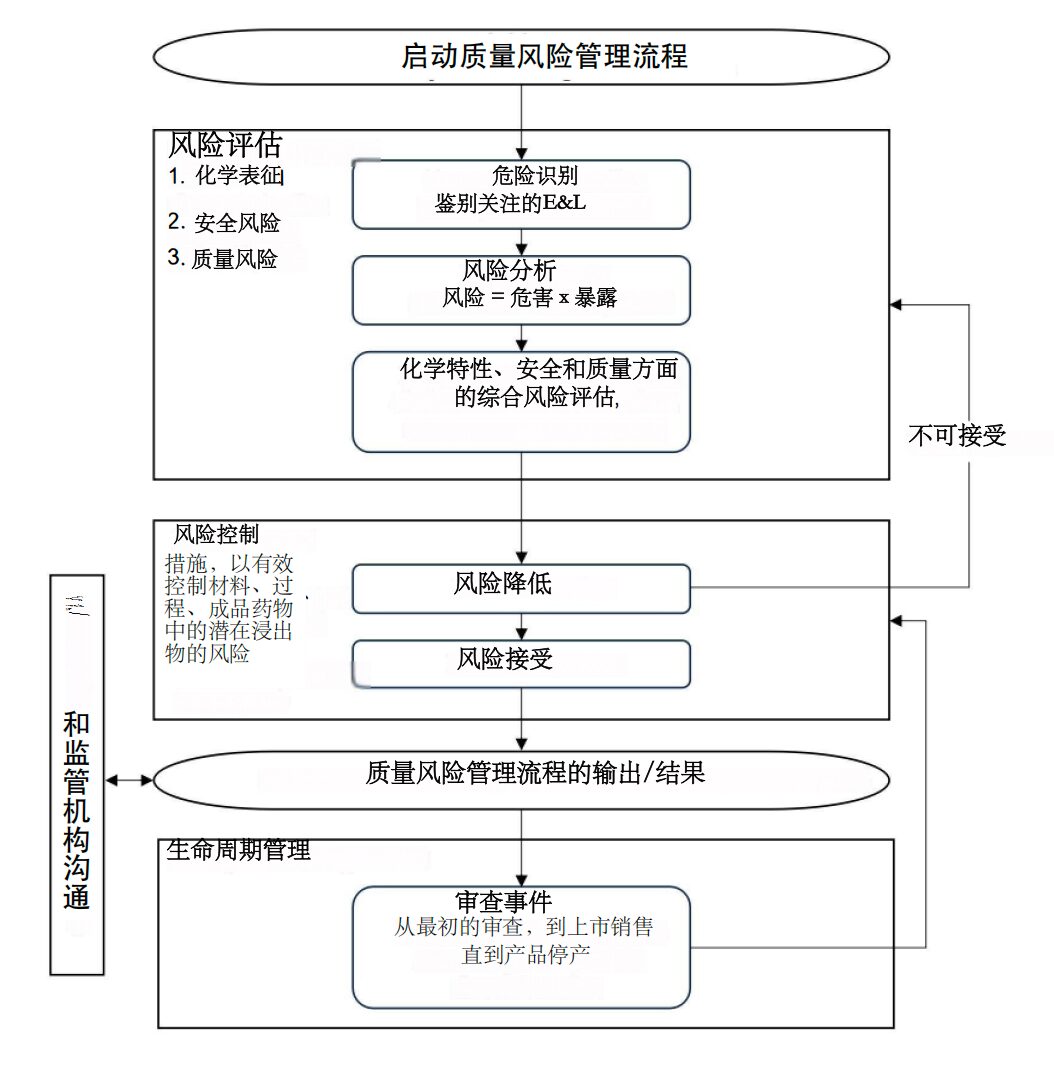
IICH Q3E 的变革性在于将源自 ICH Q9 的全面风险管理原则整合到整个 E&L 评估流程中。这与以往指导文件以规定性、一刀切方法为特征的思路截然不同。
该风险管理框架包含四个关键阶段:危害识别、风险评估、风险控制和生命周期管理。。
危害识别阶段:
系统地评估所有可能导致可提取物形成或浸出物迁移的结构材料、制造过程和储存条件,具体包括:
- 主要包装组件
- 制造设备、一次性系统、过滤器、管道
- 在生产、储存或给药过程中与药物活性成分或药品接触的任何其他材料。
风险评估阶段:
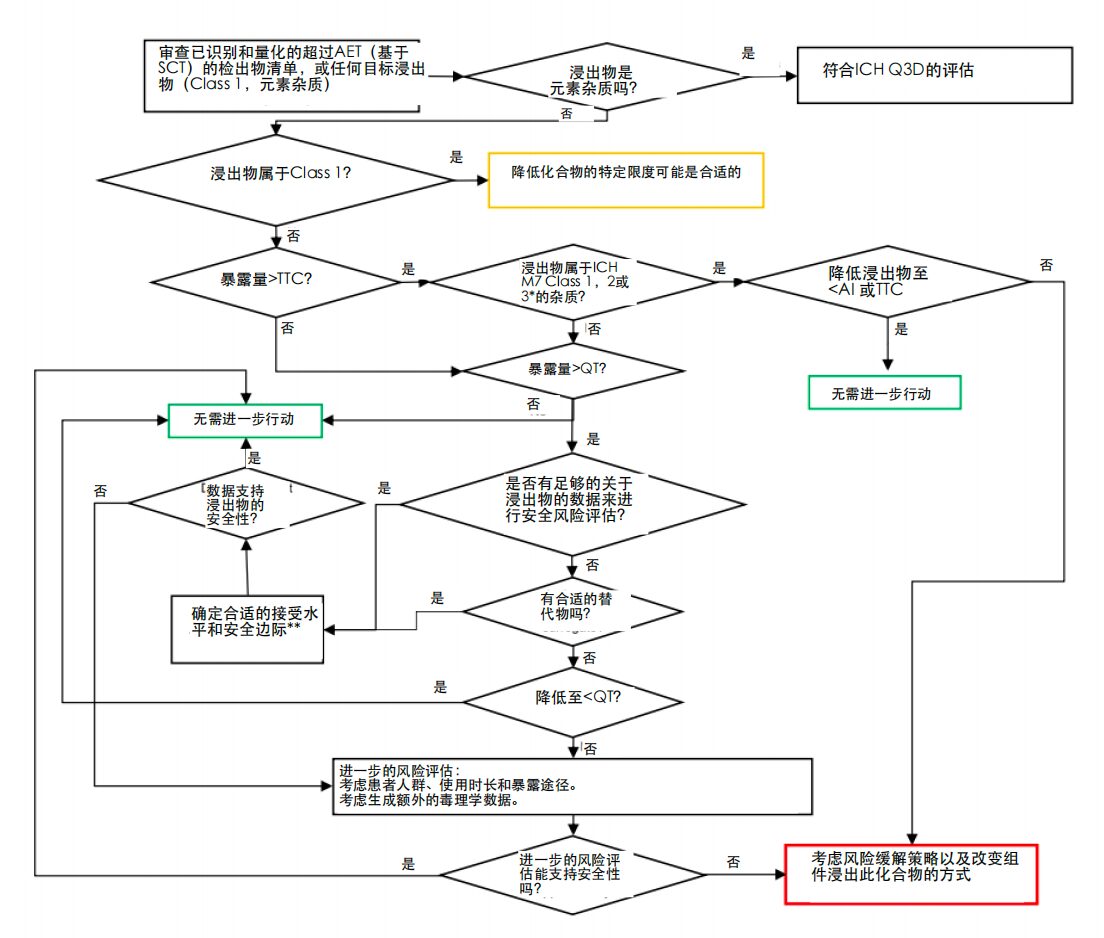
该指南强调在早期开发阶段进行风险评估,从而最大限度地降低 E&L 风险。
与以往在选定材料后简单地表征风险的做法相比,这种前瞻性的策略有助于避免因不可接受的 E&L 水平而需要在后期阶段进行材料变更,从而显著缩短开发时间并降低成本。
ICH Q3E 采用多维度的方法,综合考虑了可提取物/浸出物发生的可能性及其对产品质量和患者安全的潜在影响,涉及的因素包括:
- 接触时间
- 温度
- pH 值
- 产品浸出能力
- 给药途径
- 患者群体和治疗持续时间等
风险在不同情况下差异很大,需要量身定制的方法,而非统一划一的要求。
风险控制策略
ICH Q3E 为管理已识别的风险提供了多种可行途径,包括:
好处:与已识别的实际风险成比例,而不是在所有情况下都统一应用最大控制。制定具有成本效益的控制策略
生命周期管理
ICH Q3E 强调确保 E&L 因素贯穿产品开发、商业化和上市后监测的始终。具体包括:
- 可能表明存在担忧的新信息,例如获得关于浸出物的新患者安全信息
- 包材、给药装置或制造组件/系统的变更
- 制造过程的变更
- 可能影响患者暴露的变更
- 可能影响患者获益的变更
生命周期管理方法强调 E&L 评估不是一次性的活动,而是一个持续的过程,必须随着产品和不断更新的科学认知而发展。
ICH Q3E 的出现,标志着行业从目前由各种指南文件拼凑而成的局面,向协调统一的重大演进。
过去,这些文件在要求和安全阈值方面各有侧重,经常出现冲突,或在全球药物开发项目中造成不必要的重复。ICH Q3E 指南以其全面的覆盖范围为特点,涵盖了所有剂型的化学实体、生物制品、生物技术产品以及药物-器械组合,从而建立了一个统一的框架,更加贴合现代药物生产的实际情况。
通过 ICH Q3E 实现的协调一致,不仅限于程序上的统一,更在于确立了普适的基本科学原则,无论地理位置或具体的监管辖区如何,这些原则都应得到一致的应用。