本文详细解读了ICH Q3E的E&L风险评估的理念和策略,文末提供了完整版的ICHQ3E中文翻译稿链接。
ICH Q3E 指导原则的新发布草案,代表着全球药品领域在可提取物和浸出物 (E&L) 的评估与控制方面,迈向预期协调的重要里程碑。
该指南以 ICH Q3A、Q3B、Q3C、Q3D 和 M7 等既有标准为基础,并结合 ICH Q9 质量风险管理指导原则,采用了系统的风险管理方法,完整保留了危害识别、暴露评估和风险表征等核心内容。同时,在毒理学风险评估 (TRA) 方面也提出了创新概念。
ICH Q3E 的 E&L 评估方法
根据 ICH Q3E,风险评估遵循危害识别、暴露评估和综合风险评估这一经典的监管框架。
该框架确保同时考虑危害潜力和实际暴露水平,从而确定组件是否可接受。这种方法已被广泛应用于各个监管领域。
给药途径差异考量
新指南通过纳入特定给药途径的阈值,进一步完善了风险评估。它充分认识到,全身暴露和局部毒性潜力在口服、肠胃外、吸入和眼部等不同给药途径之间存在显著差异。
这一理念与 PQRI 基于给药途径和患者暴露持续时间设置不同限值的概念高度契合。
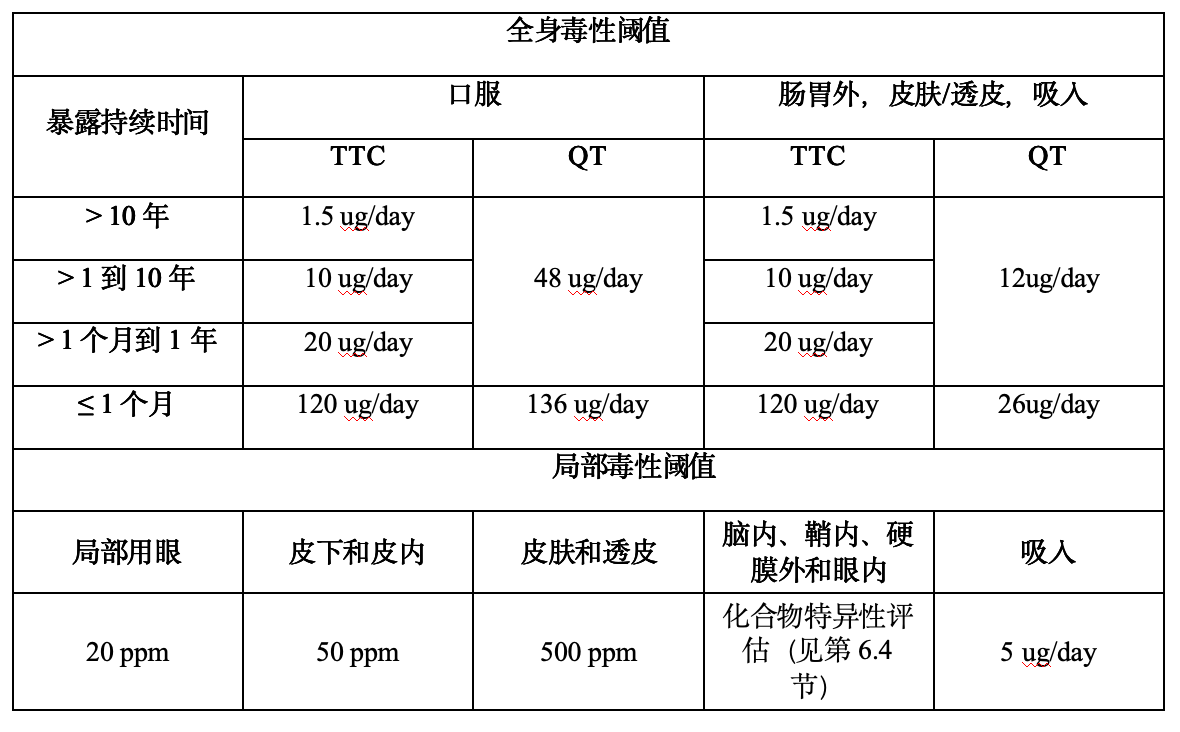
总而言之,该指南建立了一个基于风险、且科学严谨的 E&L 安全评估框架,重点关注高于安全关注阈值 (SCT) 的物质。
SCT 取决于致突变性 TTC (ICH M7) 或非致突变性界定阈值 (QT) 中的较低者,并且两者均针对给药途径和暴露持续时间进行了调整。由约 330 个 PDE 推导出的 QT 值,在口服和肠胃外给药之间有所不同。
局部用药的特殊考量:
虽然全身毒性评估通常已足够,但仍必须考虑敏感组织的局部毒性。
- 对于眼科产品,建议对局部使用浓度高于 20 ppm 的化合物进行特定评估,并且注射产品需要进行定性评估。
- 神经毒性问题适用于脑内、鞘内和硬膜外途径,即使在极低的浓度下也需谨慎对待。
- 对于皮肤产品,致敏是最敏感的终点。皮肤致敏阈值 (DST) 为 1 µg/cm²/天(约 500 ppm),低于此阈值的暴露通常不需要进一步的局部毒性审查。
- 呼吸道致敏缺乏可靠的预测工具,需要根据具体情况进行个案审查。
- 由于更高的免疫细胞接近度,皮下和皮内途径使用 50 ppm 阈值,而静脉和肌肉内途径在典型的 E&L 水平下不太可能构成致敏风险。
创新之处:引入结构化的 E&L 分类系统
E&L 分类
根据毒理学特征和所需控制的严格程度,E&L 被分为基于效力的类别1 类(Class 1)、2 类(Class 2)、3 类(Class 3)。
1 类(Class 1):高关注类别,应尽可能避免
- 涵盖 ICH M7 “关注队列”中的致突变性致癌物、可接受摄入量低于 1.5 µg/天的 ICH M7 1 类化合物,以及某些高效非致突变物,如双酚 A 或苯并[a]芘。
- 该类别中的物质,其默认阈值提供的保护可能不足,应尽可能避免使用。如果必须使用,则应通过强大的科学论证支持的化合物特定 PDE 来进行控制。
2 类(Class 2):默认类别,限制类。
- 依照标准的致突变性 TTC 或非致突变性 QT 值。这些阈值是途径和持续时间特定的,并且从大量的浸出物 PDE 数据集中导出。
3 类(Class 3):低毒性物质
- 其 PDE 值远高于典型 E&L 发现的浓度。如果暴露量保持在 1 mg/天以下,则通常不需要进一步的鉴定。
将化合物分配到特定类别,取决于是否有足够的毒理学信息来做出判断。许多实际案例属于“未列出”类别,即缺乏已发布的 PDE 或足够的毒性数据。
对于这些情况,ICH Q3E 附录 5 阐述了如何从毒理学文献中推导出 PDE,以及如何选择起始点 (PoD)。
需要注意的是:
不恰当的因子选择或过于保守的默认值,可能会将 PDE(以及因此允许的浸出物限值)降低到不切实际的水平,从而可能迫使进行不必要的重新配方或重新包装。。
安全限值确定
在 ICH 指导原则的背景下,ICH Q3E 对允许日暴露量 (PDE) 的推导,遵循了ICH Q3E和ICH Q3D的公式,但引入了两个额外的修正因子:F6 和 F7
F6:
用于解释生物利用度的差异。 当将毒性数据从一种暴露途径外推到另一种途径(例如,口服到肠胃外)时,应用 F6。
- 如果口服生物利用度 <1%,则 F6 = 100
- 如果口服生物利用度 ≥1% 且 <50%,则 F6 = 10
- 如果口服生物利用度 ≥50% 且 <90%,则 F6 = 2
- 如果口服生物利用度 ≥90%,则 F6 = 1
F7:
用于使用交叉读取方法 (Read-Across) 来替代来自相似化合物的数据。
- 根据结构和毒理学相似程度,可以应用高达 5 的附加因子;
- F7 = 1 保留给满足指南中相似性标准的替代物。
安全边际(MOS)的计算,是长期建立的毒理学实践,已经嵌入在其他杂质或医疗器械表征指导原则中。
是否可以在没有动物试验的情况下评估可提取物和浸出物?
附录 5 提出:可以使用来自结构相似物质的数据来评估具有有限直接数据的浸出物的安全性。如果考虑到化学和毒理学相关性选择类似物,这与计算机模拟工具和体外方法一起,提供了一种无需诉诸新的动物研究即可获得科学合理 PDE 的途径。
指南并未提供对其接受度的明确标准,而是将其留给评估人员和审查机构来商定其有效性。
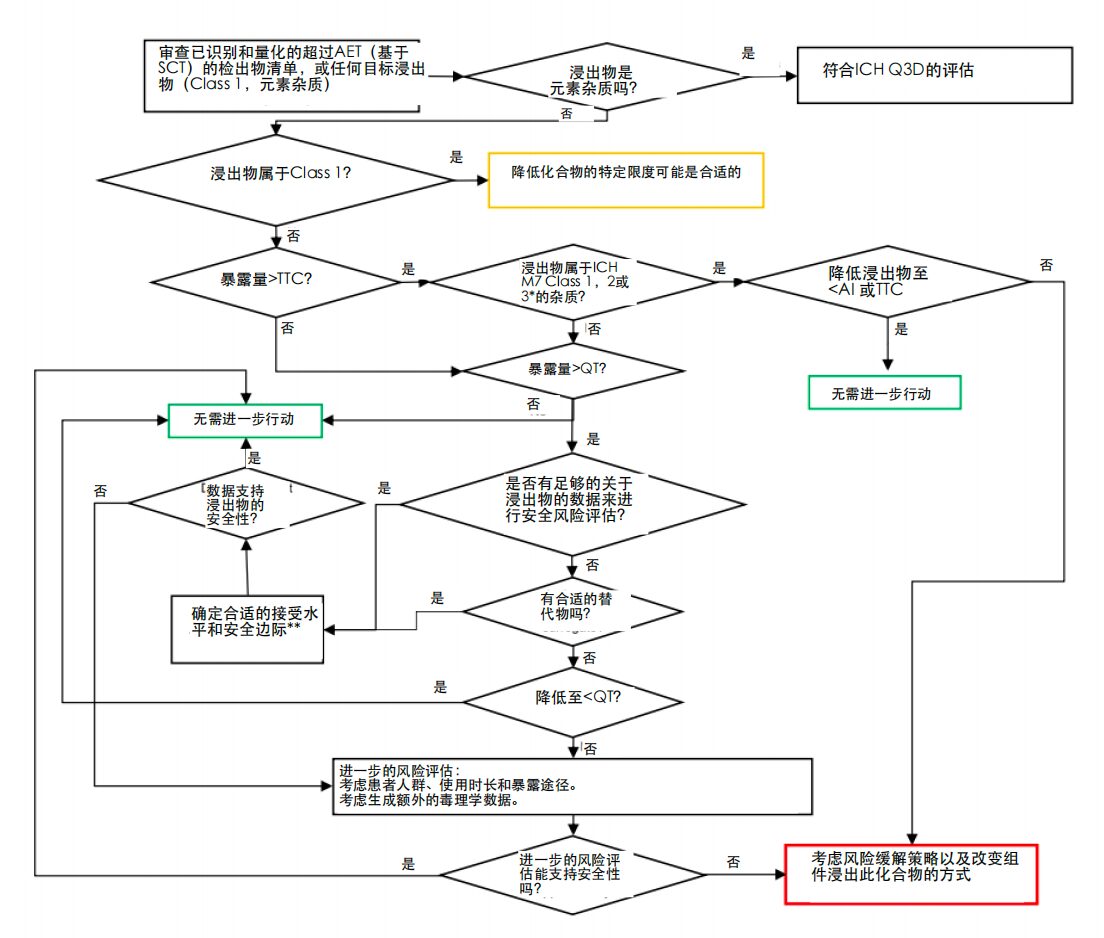
安全评估决策树
ICH Q3E将安全评估提炼成一个决策树,将致突变性和一般毒性终点联系起来。
该流程图说明了浸出物的整体安全评估过程,集成了致突变性和一般毒性的评估,确保全面解决潜在风险,并符合良好的毒理学实践。
- 对高于分析评估阈值 (AET) 的浸出物进行分类,并应用 QT 阈值进行评估。
- 1 类化合物需要化合物特定的限值,而其他化合物则根据致突变性 TTC 和非致突变性 QT 进行评估。
- 超标情况必须通过减少暴露、进行毒理学鉴定、应用交叉读取(Read-across)或生成新数据来管理。
- 对于诱变剂,基因毒性测试可能会降低其风险;对于非诱变剂,亚慢性或慢性研究可以完善 PDE。
尚存的疑问:
例如,“是否有足够关于浸出物的数据来进行安全风险评估”的菱形决策框隐藏了一个主要的复杂性:如何界定“足够的数据”?如何实现数据的充分性?
在实践中,许多浸出物是从 LC-MS 中初步鉴定的,缺乏完整的结构解析,因此评估人员需要根据亚结构和类似物数据做出判断。在这种情况下,过度解读计算机模拟警报可能会将临界 2 类物质错误地划归为 1 类,从而产生重大的监管和运营影响。
总而言之,ICH Q3E 指导原则草案为药品中 E&L 的评估与控制提供了更清晰、更细致的框架。它强调了基于风险的评估方法,考虑了给药途径的差异,并引入了创新的 E&L 分类系统。
**阅读【重磅!ICH Q3E 药品E&L指导原则中文版】,免费获取 ICH Q3E 指导原则中文版,或通过文末联系方式获取更多支持!