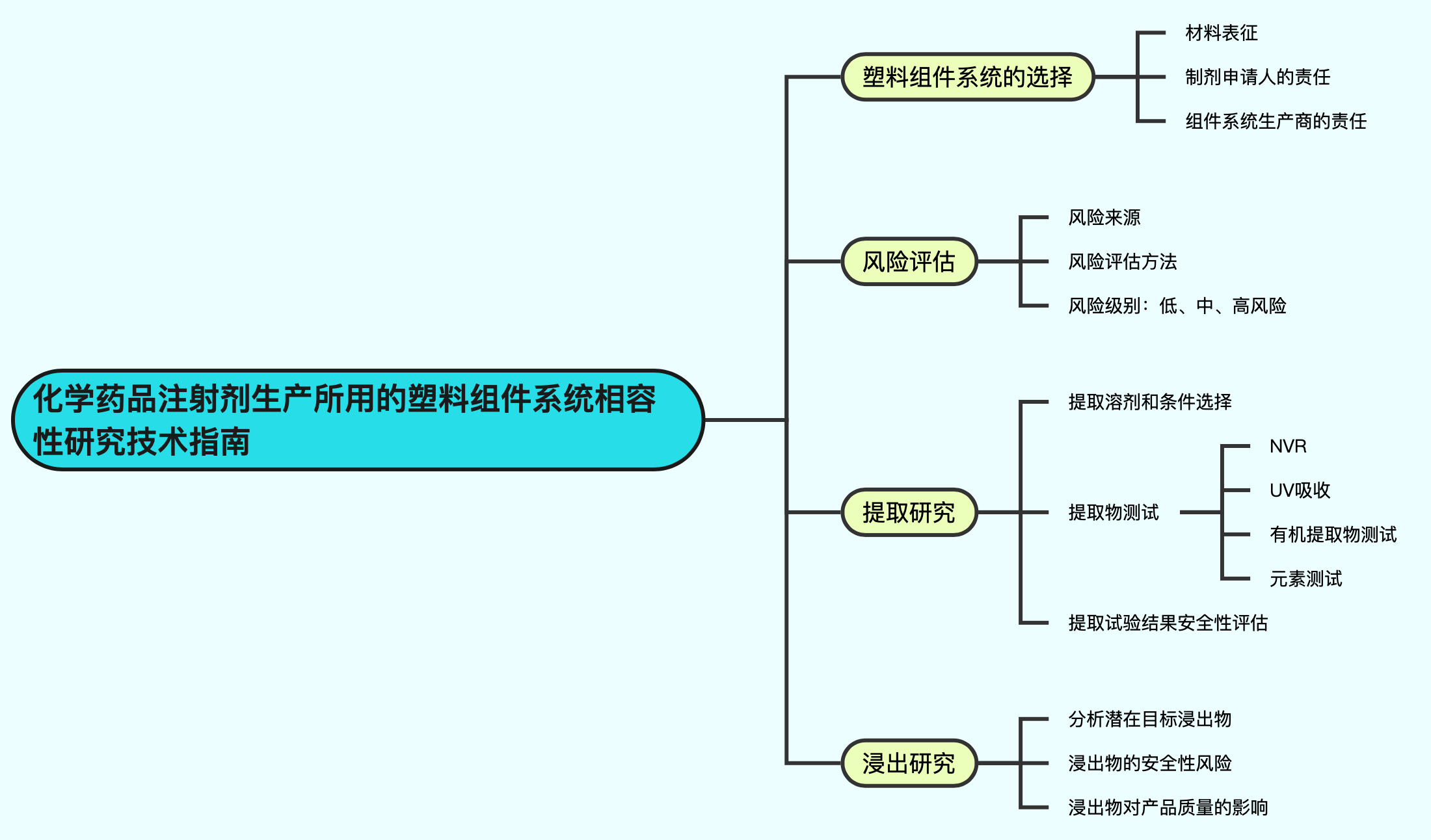
阐述了化学药品注射剂生产过程中使用的塑料组件系统的相容性研究思路。制剂申请人在选择组件系统时应全面了解材质、牌号、生产过程、使用前预处理方式等信息,并进行科学评估。强调了风险评估的重要性,提出相容性研究的具体方法和步骤。
组件系统的质量控制要求
- 生产商应对所选材料的质量进行把关,避免使用有毒有害的添加剂。
- 组件系统应满足相关法规的要求,如材料法规符合性声明、特殊关注物质的声明或承诺等。
- 生产商应建立质量保证体系,确保组件系统的质量符合要求。
风险评估的步骤
- 建立风险评估方法,考虑浸出可能性和持续存在的可能性等因素。
- 风险评估维度,包括接触材料或组件系统的化学和物理性质、接触液体的化学性质、接触条件的影响、浸出物被消除或稀释的能力、与产品相关的固有风险等。
- 根据评估结果确定风险级别(高、中、低风险)。
提取研究
根据风险评估开展相应的提取研究工作。
浸出研究
对提取研究结果进行安全性评估,如需要进一步开展浸出试验,可参照相关包材相容性研究指南的思路开展研究,合理设计试验。
化学药品注射剂生产所用的塑料组件系统相容性研究技术指南(试行)