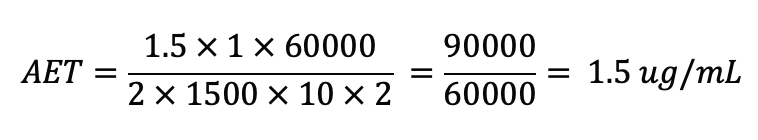USP<665>、USP<1665>和Biophorum(BPOG)可提取物测试协议,用于生产生物药品的一次性生物加工系统的提取研究和风险评估,目的是来确保一次性生产组件系统的安全性和适用性。
本文通过实例来详细阐述风险评估流程、分析评估阈值(AET)的应用、以及如何根据生产过程的具体条件来评估和选择合适的提取研究条件。
引言
在传统的制药生产过程中,玻璃和不锈钢设备是标准配置。尽管这些材料在小分子生产中仍被广泛采用,但在大分子生物制药生产中,聚合物一次性生产设备(一次性生物加工系统)的使用日益普及。与不锈钢和玻璃材料相比,聚合物生产组件带来了诸多明显的优势,包括:
- 成本节约
- 灵活性和可扩展性的提升
- 更快的更换速度
- 减少对基础设施的需求
- 降低交叉污染的风险
一次性技术在生物制药行业中已得到广泛采纳。作为最终用户,制药企业负责确保其生产过程中使用的设备适宜性,并越来越重视供应商提供的高质量数据。更严格的质量协议要求供应商对供应链进行更严格的管理,任何材料或生产工艺的变更都需要及时且充分地通知。
Biophorum(BPOG)可提取物测试协议旨在帮助供应商以标准化格式生成可提取物数据,这些数据可以被多个最终用户共享和使用。
尽管供应商可能已经生成了可提取物数据,但最终用户组织仍需确保这些数据的生成方法能够真实反映其工艺流程。监管机构要求最终用户确保用于生产药品的材料适合其预期用途。在这方面,USP<665>的制定考虑了最终工艺流程,因此所需的测试和报告阈值是针对特定工艺设定的。
本文将研究特定的一次性组件的可提取物数据,并根据生产过程,探讨USP<1665>中定义的风险评估流程,提出评估提取数据的方法。
风险评估
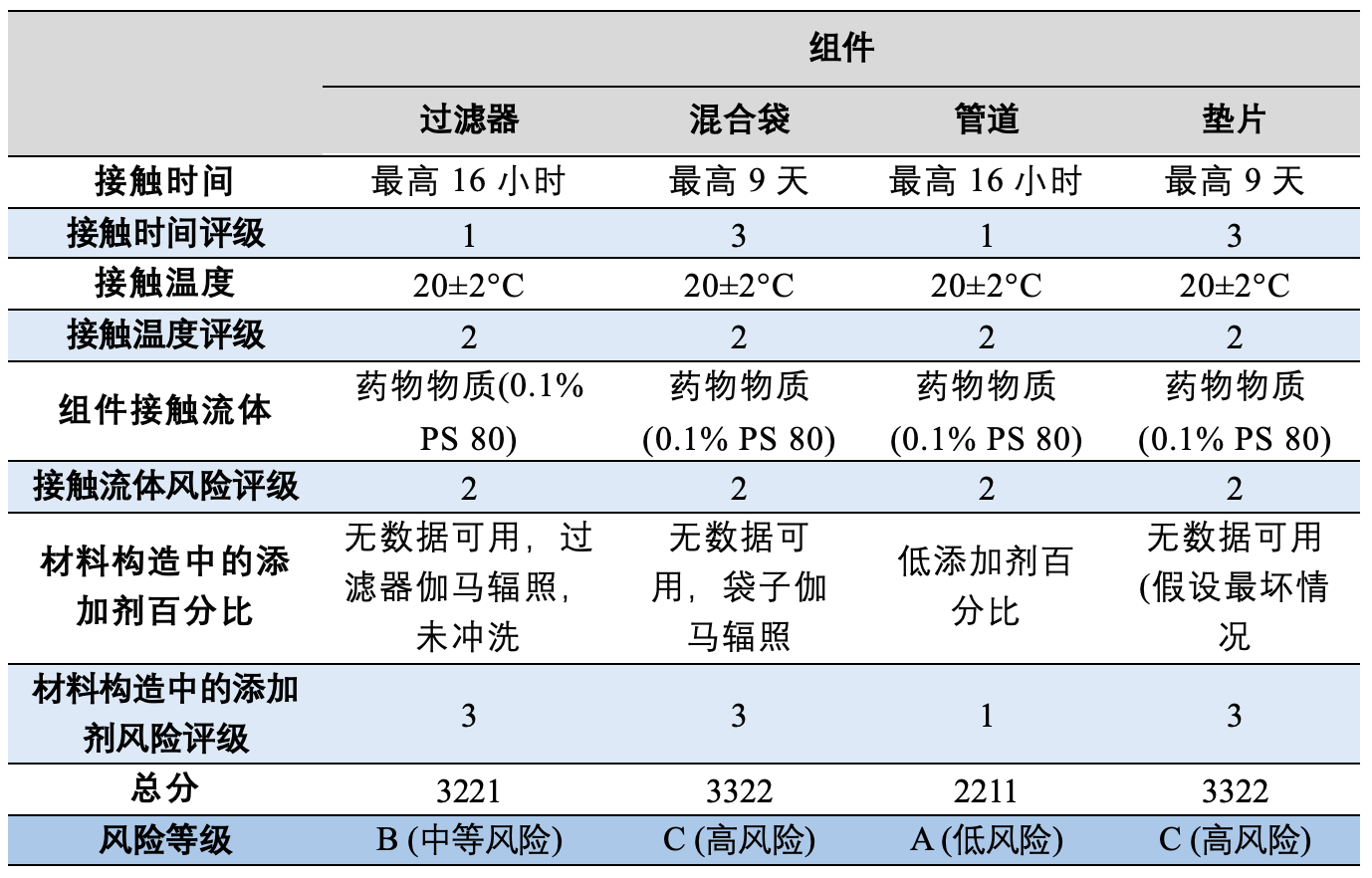
根据USP<665>,初步风险评估决定了所需的测试水平,这有助于确定在特定生产过程中使用组件的最适当提取条件,可参考文章如何进行生产组件的风险评估:原则和实践。USP<1665>详细阐述了风险评估过程,旨在确定可浸出物迁移的风险,考虑因素包括组件是否接触液态或半固态流、是否与比较器组件或系统相等、接触时间、接触温度、接触流体的组成以及组件材料构造中的添加剂百分比。
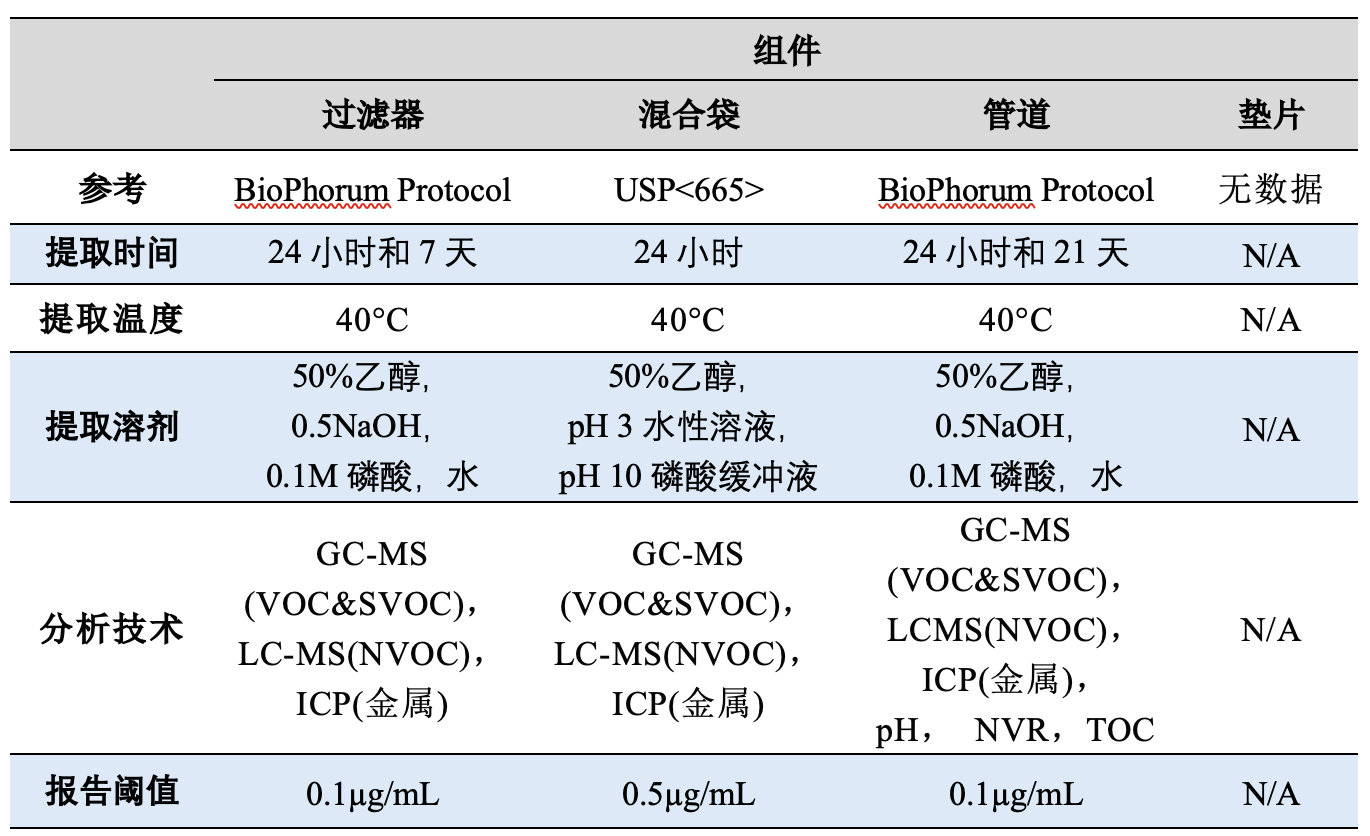
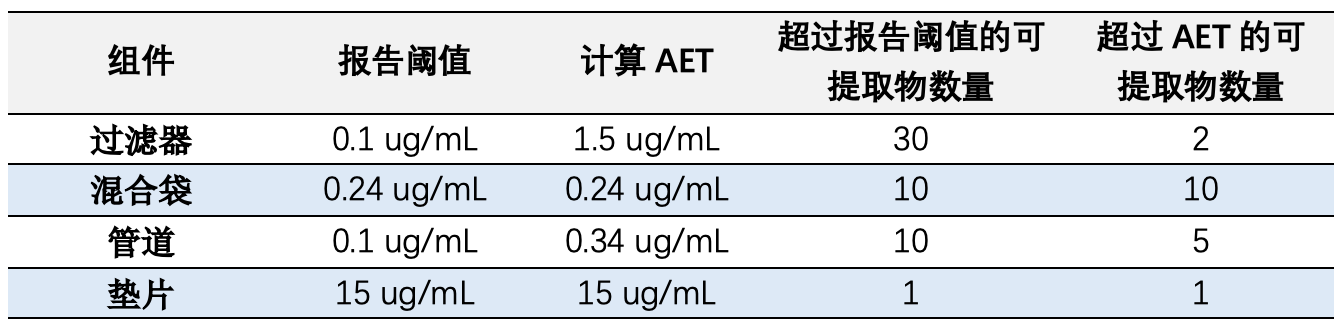
采用USP<1665>中定义的方法,对生产过程中的四个聚合物组件进行了风险评估,可参考文章生产组件相容性研究USP<665> Q&A。表1提供了与组件相关的风险评估得分。一些组件供应商提供了提取研究数据,表2展示了供应商提供的提取研究条件。
AET值的应用
为了确定组件的潜在影响,必须进行毒理学评估。定义分析评估阈值(AET)是至关重要的。AET与特定产品的生产过程对齐是一个关键考量。因此,可提取物数据应设定一个报告阈值,这个阈值足够低,以确保毒理学家确信低于此阈值的分析物对患者安全的风险可以忽略不计。任何高于这个阈值的物质都应进行评估。
BioPhorum(BPOG)协议规定了0.1µg/mL的通用报告阈值,而USP<665>则要求考虑与实际药品生产相适应的AET。
以“过滤器”组件为例,提取研究采用了BioPhorum(BPOG)协议建议的0.1µg/mL报告阈值。为确保该组件符合USP<665>,通过以下计算确定了AET。
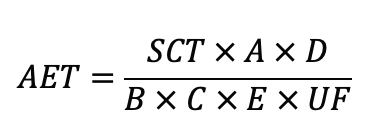
SCT = 安全关注阈值(µg/天)
A = 测试样品数量或提取的表面积(样品数量或cm2)
B = 生产过程中的测试样品数量或表面积(样品数量或cm2)
C = 提取体积(mL)
D = 生产的剂量(Dose)
E = 患者每天接触的剂量数量(Dose/天)
UF = 分析方法不确定性因子
提取数据评估
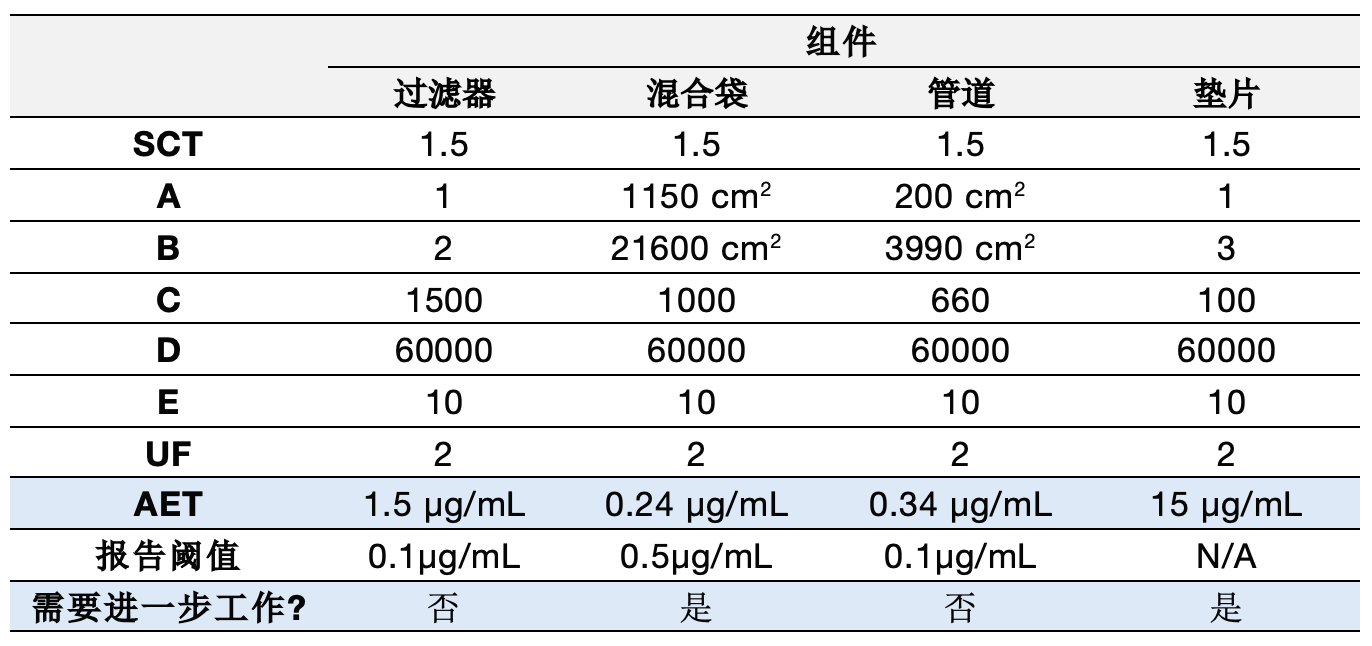
重要的是要确认提取报告阈值是否适用于组件在生产过程中的使用方式。基于药品的每日剂量,报告阈值应等于或低于组件的计算AET。提取研究的条件应涵盖生产过程的极端或“最坏”情况。
过滤器:被评定为中等风险组件,根据USP<665>,至少需要使用50:50乙醇水进行有机可提取物分析。提取研究采用了与实际使用条件相比的最坏情况的提取时间、温度和溶剂。此外,报告阈值低于计算的AET,因此,该组件不需要进一步的提取工作。
混合袋:被评定为高风险组件,需要最高级别的化学测试。供应商提供了符合USP<665>的混合袋数据。根据生产过程条件,至少需要9天的提取数据。AET低于报告阈值,因此,需要生成低于报告阈值(≤0.34 µg/mL)的数据,以确定在过程中使用材料的风险。因此,该组件需要进一步的提取工作。
管道:被评定为低风险组件,根据USP<665>,只需要NVR和UV吸光度数据。供应商根据BioPhorum协议提供了数据,包括pH、NVR和TOC数据。尽管没有UV吸光度数据,但其他可用数据(GC-MS、LC-MS和ICP)意味着不需要额外的UV数据。提取研究采用了与实际使用条件相比的最坏情况的提取时间、温度和溶剂。报告阈值低于计算的AET,因此,该组件不需要进一步的可提取物工作。
垫片:被评定为高风险组件,需要最高级别的化学测试。目前没有垫片的数据,因此,需要进一步的测试,AET为15 µg/mL。
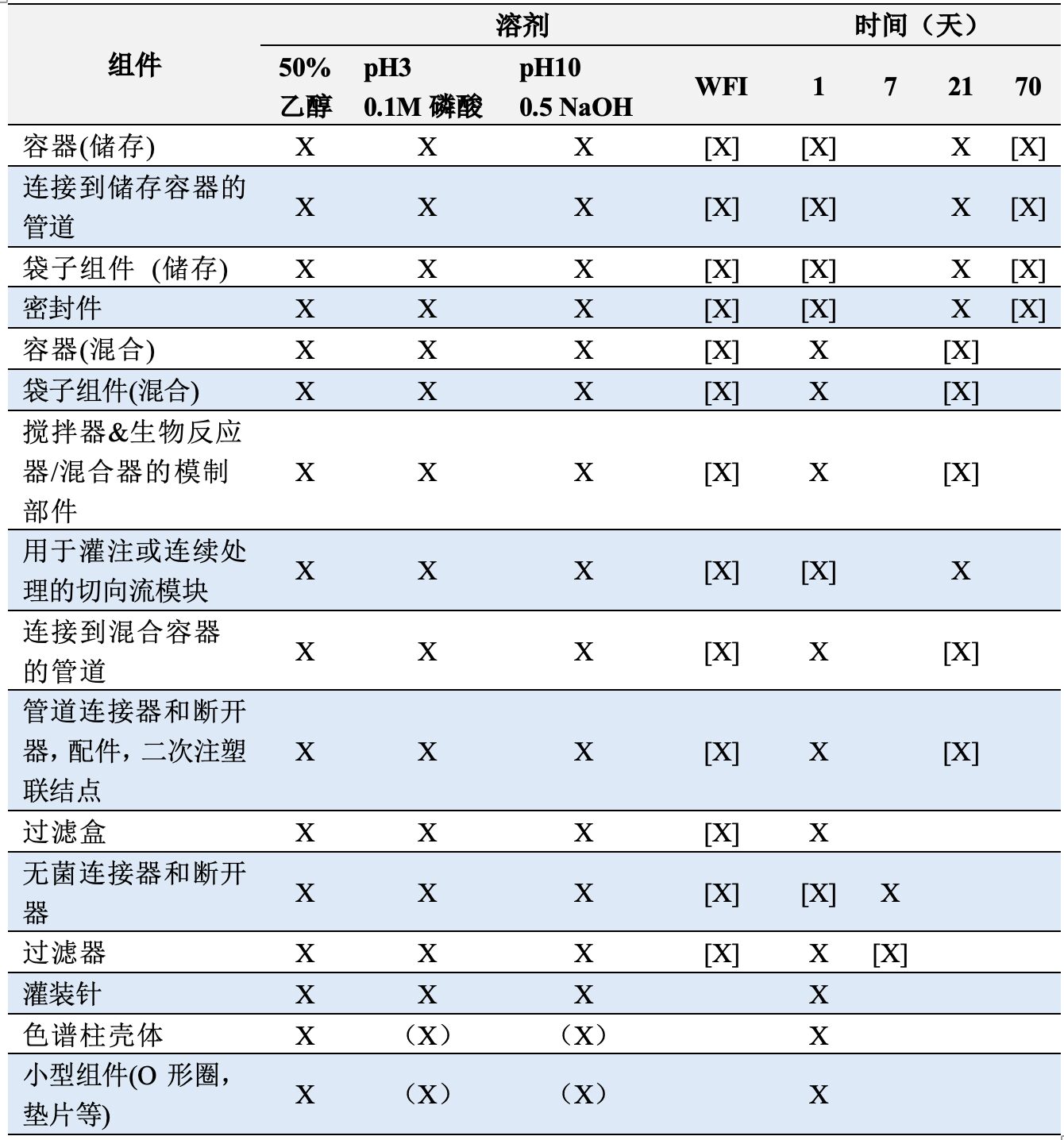
USP<665>根据组件的风险类别有3个不同级别的测试,而BioPhorum协议没有使用相同的基于风险的方法。表4总结了USP<665>和BioPhorum(BPOG)提取条件的相似之处和差异。
表4 USP<665>和BioPhorum(BPOG)的提取细节概述
备注:
- X:USP<665> & BPOG
- (X):仅USP<665>
- [X]:仅BPOG
数据评估
高于分析评估阈值(AET)的可提取物应由毒理学家评估,以确定对患者安全的潜在风险。尽管供应商报告了过滤器和管材的许多可提取物,但并非所有可提取物都高于AET,只有高于AET的可提取物应进行毒理学评估。混合袋和垫片的报告阈值已与AET一致,因此,所有检测到的分析物都应进行毒理学评估。
最后
USP<1665>中呈现的风险评估可以用于确定所需的测试。重要的是要确保在研究中生成的可提取物数据能反映特定生产工艺中合格组件的最坏情况。
尽管依照USP和BioPhorum指南生产的可提取物数据可以为大多数使用案例提供最坏情况数据,但它们并不能涵盖所有可能性。最终用户有责任确保有足够的数据来评估在其流程中使用特定组件或材料的潜在风险。
参考
- www.element.com
- Biophorum Operations Guoup (BPOG). Best Practices Guide for Extractables Testing of Polymeric Single-Use Components Used in Biopharmaceutical Manufacturing(2020).
- United States Pharmacopeia < 665 > Plastic components and systems used to manufacture pharmaceutical drug products and biopharmaceutical drug substances and products.
- USP PF<1665> Characterization of Plastic Materials, Components, and Systems Used in the Manufacturing of Pharmaceutical Drug Products and Biopharmaceutical Drug Substances and Products.