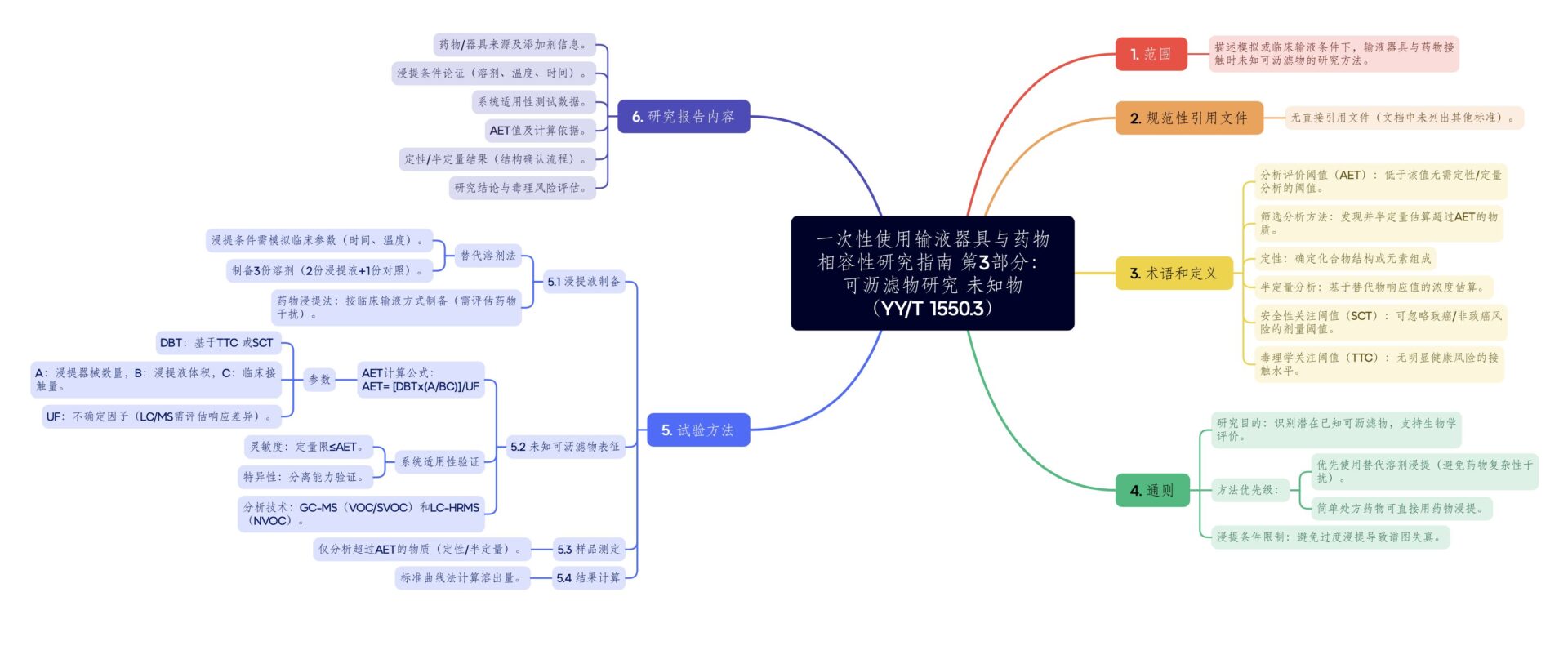
本文详细解读YY/T 1559.3标准,根据性"化学表征-毒理学评估-风险控制"技术框架,明确了未知可沥滤物的安全风险管控的要求,引入AET(分析评估阈值)计算,量化未知物毒理学阈值,结合色谱质谱联用技术实现痕量物质鉴别,为输液器具容性评估提供法规依据和可操作性指导。
1. 标准概述
针对输液器具中识别潜在的已知可沥滤物的研究,也可用于支持生物学评价。未知可沥滤物是指在临床使用过程中,从医疗器械中释放出但尚未被识别的化学物质。
2. 适用范围
本标准适用于需要开展未知可沥滤物研究的特定输液器具,与经论证的药物替代溶剂或拟输注的药物开展未知可沥滤物研究。
3. 试验方法
(1)浸提液的制备
可使用替代溶剂或药物制备浸提液。替代溶剂的选择需综合考虑拟研究器械在临床上所接触药物的极性和酸碱度等特性。浸提溶剂需制备三份,其中两份按经论证的浸提⽅式制备,另⼀份置相同条件下作为空白对照。
关键点:
- 药物浸提仅限简单处方药物(无复杂杂质干扰)。复杂基质采用替代溶剂浸提。
- 制备参数需考虑给药剂量、输液载体、稀释⽅式、输液⽅式、输 液速度、输液温度。
替代溶剂选择见输液器具相容性|替代溶剂的选择策略
(2)未知可沥滤物表征
需同时考虑有机物和无机物,采用多种分析技术联合的未知物分析体系,对浸提液中的未知可沥滤物进行定性和半定量分析。
关键点:常用分析技术包括GC-MS、LC-UV,LC-MS、AAS、ICP-MS、IC等。
(3)分析评价阈值(AET)的建立
在进行未知可沥滤物分析前应确定并论证AET,AET最好来源于基于安全性的阈值(如TTC)。通过考虑医疗器械临床使用的频率和持续时间、浸提条件等因素计算AET。

其中:
- B:浸提医疗器械的数量(即实验中使用器械的件数);
- H:浸提液的体积(单位为毫升,mL);
- C:用户每天接触的器械数量(根据临床实际使用确定);
- DBT:基于剂量的阈值(通常参考毒理学关注阈值TTC或安全性关注阈值SCT,参考ICH M7),单位为µg/天;
- UF:不确定因子(分析方法的误差补偿,通常为2~10,GC/MS取2,LC/MS需校正)。
(4)系统适用性考察
对分析系统和参数进行验证,确保其有足够的灵敏度和分离各种潜在可沥滤物的能力。
关键点:采⽤经论证和确认的一组替代化合物,对建⽴和确认组成未知物分析体系的分析技术进⾏系统适⽤性验证,验证内容包括:灵敏度(定量限需≤ AET)、特异性(专属性)。
4. 样品测定和结果计算
取标准对照溶液和浸提液进行测定,对超过AET的物质进行定性和半定量/定量分析。
计算可沥滤物中被测物的浓度,进而计算出该物质在一整套样品中的溶出量。
5. 报告
- 药物、输液器具、临床使用信息
- 浸提条件及论证
- 系统适用性测试和结果
- 报告阈值(如AET)值计算和论证
- 定性数据
- 定量数据
- 试验过程和试验结果
YYT 1550.3 一次性使用输液器具与药物相容性研究指南 第3部分可沥滤物研究 未知物 思维导图